Dit artikel gaat over het promotieonderzoek van Wieke Haakma naar nieuwe afbeeldingstechnieken om de diagnostiek van verschillende zenuwziekten te optimaliseren. Het onderzoek is uitgevoerd in het Universitair Medisch Centrum Utrecht.
Achtergrond
Het perifeer zenuwstelsel is een netwerk van zenuwen waardoor motorische (beweging) en sensorische (gevoel) informatie wordt uitgewisseld binnen het lichaam. Via de perifere zenuwen vindt communicatie plaats tussen de hersenen enerzijds en de organen, spieren, bloedvaten en de huid anderzijds. De zenuwen bestaan uit een motorisch gedeelte dat het signaal van de hersenen naar bijvoorbeeld spieren stuurt en uit een sensorisch gedeelte welke het signaal weer terugzendt naar de hersenen.
Beschadiging van (delen) van dit perifeer zenuwstelsel kan verstoring tussen de hersenen en het gebied dat door de zenuwen wordt geïnnerveerd veroorzaken. Dit kan bijvoorbeeld leiden tot tintelingen in de handen en voeten en kan zelfs uiteindelijk tot spierzwakte of spieruitval leiden.
Er zijn verschillende oorzaken waardoor het perifeer zenuwstelsel kan beschadigen. Zo kan dit komen door een virus, overmatig alcoholgebruik of bijvoorbeeld doordat iemand erfelijk belast is met een zenuwaandoening. Erfelijke aandoeningen zijn vaak zeldzaam en in praktijk soms lastig te identificeren. Om de juiste diagnose te kunnen stellen wordt neurologisch onderzoek gedaan, wat kan bestaan uit het testen van reflexen en kracht, of bijvoorbeeld het meten van spier – en zenuwsignalen (electromyogram, EMG). Het kan echter erg lastig zijn om de juiste diagnose te stellen, omdat symptomen van verschillende ziekten erg op elkaar kunnen lijken.
De techniek
Diffusie tensor imaging (DTI) is een magnetic resonance imaging (MRI) techniek die diffusie (beweeglijkheid) van watermoleculen kan meten (zie ook het eerder verschenen MT Integraal artikel ‘Kwantificatie van diffusie-gewogen beeldvorming in borst en lever weefsel’). Wanneer deze diffusie ongehinderd is (bijvoorbeeld in een glas water) kunnen de watermoleculen in elke richting vrij bewegen; dat wordt isotrope diffusie genoemd. In het menselijk lichaam worden watermoleculen echter vaak gehinderd in hun baan, door bijvoorbeeld celmembranen. Hierdoor kan het zijn dat de diffusie juist voornamelijk in één richting is georiënteerd, ook wel anisotrope diffusie genoemd.
Deze anisotropie kan in kaart worden gebracht, door het toepassen van een zogeheten diffusie-gewogen MRI, waarbij met verschillende diffusie gradiënten en oriëntaties de richting (tensor) van de diffusie kan worden geschat (zie Figuur 1). Hierdoor is het mogelijk de micro-structurele eigenschappen van (zenuw)weefsel in kaart te brengen. Zenuwen hebben een sterke anisotropie, omdat diffusie makkelijker plaatsvindt over de lengterichting van de zenuw. De techniek waarmee de zenuwen kunnen worden gereconstrueerd uit de diffusiedata heet fiber tractografie.
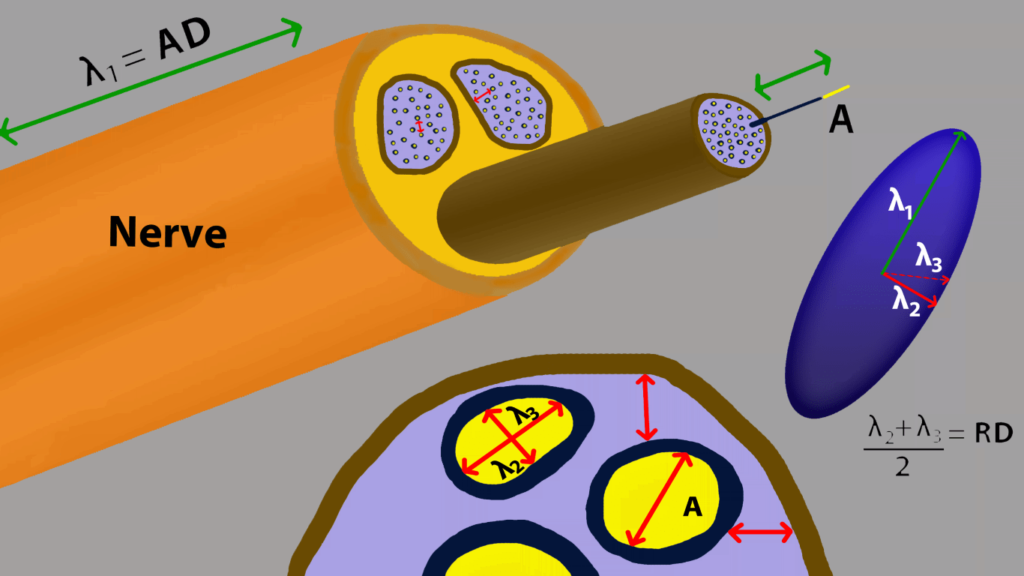
Schematische weergave van diffusie in perifere zenuwen en axonen (A). De ellips is een tensor met 3 eigenvalues (λ1, λ2 en λ3) wat de lengte van de diffusie in een bepaalde oriëntatie representeert. De diffusie in zenuwweefsel is hoger in de lengterichting van de zenuw (axiale diffusie, AD of λ1) dan loodrecht op de zenuw (radiale diffusie, RD of (λ2+λ3)/2)). Deze voornamelijk in één richting georiënteerde diffusie heet anisotrope diffusie [1].
Diffusie is in gezond zenuwweefsel georiënteerd langs de zenuw. Deze diffusie kan worden gerepresenteerd als een tensor met 3 zogeheten eigenvalues λ1, λ2 en λ3 (zie Figuur 1) Wanneer er schade optreedt dan kan het zijn dat deze diffusie-eigenschappen veranderen. De diffusieparameters die kunnen worden berekend zijn: de fractionele anisotropie (FA), deze is hoog als diffusie voornamelijk in één richting georiënteerd is, de gemiddelde diffusie (MD = (λ1 + λ2 + λ3 )/3), dit is het gemiddelde van drie eigenvalues dus de totale diffusie, de axiale diffusie (AD = λ1), dit is de grootste eigenvalue, en de radiale diffusie (RD = (λ2 + λ3)/2), deze is gedefinieerd als het gemiddelde van de tweede en derde eigenvalue (zie Figuur 1) [1].
Hoewel DTI veel wordt gebruikt in de hersenen om bijvoorbeeld zuurstoftekort (ischemie) aan te tonen, wordt het minder vaak toegepast in het perifeer zenuwstelsel. Een reden daarvoor is bijvoorbeeld dat het verkrijgen van de beelden uitdagender is. Beweging van bijvoorbeeld het hart kan voor vervelende verstoringen zorgen in het beeld. Ook kunnen overgangen van bijvoorbeeld lucht naar weefsel, zoals bij de longen het geval is, verstoringen veroorzaken, waardoor beeldvorming met DTI in die regio extra lastig is.
Het ziektebeeld
Multifocale motorneuropathie (MMN) is een zeldzame ziekte die in ongeveer 1 op de 100.000 mensen voorkomt. De ziekte kenmerkt zich doordat het progressief, multifocaal (op meerdere plaatsen tegelijk) en asymmetrisch is, met zwakte in de extremiteiten (armen en benen) waarbij primair het motorische gedeelte van de zenuw is aangedaan. De diagnose van MMN wordt gebaseerd op een combinatie van klinische en elektrofysiologische testen om abnormaliteiten in de zenuwen op te sporen (blokkades in geleidbaarheid) en door het uitsluiten van andere aandoeningen, zoals bijvoorbeeld amyotrofe laterale sclerose (ALS). Dit laatste kan erg lastig zijn, omdat de symptomen van beide ziektes erg op elkaar kunnen lijken. Waar MMN goed te behandelen is en een normale levensverwachting heeft, is er tot dus ver geen behandeling voor ALS en hebben deze patiënten een prognose van 3 tot 5 jaar. Het is daarom van groot belang om de juiste diagnose adequaat en in een vroeg stadium vast te stellen om het verdere beloop van de ziekte beter in te kunnen schatten en eventuele therapie in te kunnen zetten. Daarnaast is het zo dat de pathologische mechanismen achter deze ziekten niet volledig wordt begrepen. In het hier beschreven onderzoek beogen we om meer inzicht te verkrijgen in de verschillen tussen de ziektebeelden op zenuwniveau.
Het onderzoek
In het uitgevoerde onderzoek dat wij hebben gedaan in het Universitair Medisch Centrum Utrecht (UMCU) willen we bekijken wat de toegevoegde waarde van MRI en DTI kan zijn bij het diagnosticeren en het in kaart brengen van de pathofysiologische eigenschappen van MMN en ALS. MRI kan anatomische informatie geven over de morfologie van de zenuwen, waarbij DTI juist functionele informatie geeft over (veranderde) diffusie-eigenschappen van het zenuwweefsel [2].
De methode
In dit onderzoek hebben we 10 patiënten met MMN, 10 patiënten met ALS en 10 gezonde personen geïncludeerd. Bij alle personen zijn de zenuwen in beide onderarmen onderzocht met behulp van klinische testen, EMGs, MRI en DTI. Hierbij hebben we specifiek naar twee van de zenuwen in de onderarm gekeken, de nervus medianus en ulnaris. De klinische testen en de EMGs hebben we gebruikt om de ziekte in kaart te brengen en met behulp van MRI en DTI waren we in staat om de anatomie (oppervlakte van de zenuwen) en diffusie-eigenschappen van het zenuwweefsel te onderzoeken. Hierbij hebben we specifiek naar de eerdergenoemde diffusieparameters gekeken: de FA, de MD, de AD en de RD. Daarnaast hebben we met behulp van fiber tractografie de zenuwen in de onderarm gereconstrueerd (zie Figuur 2).
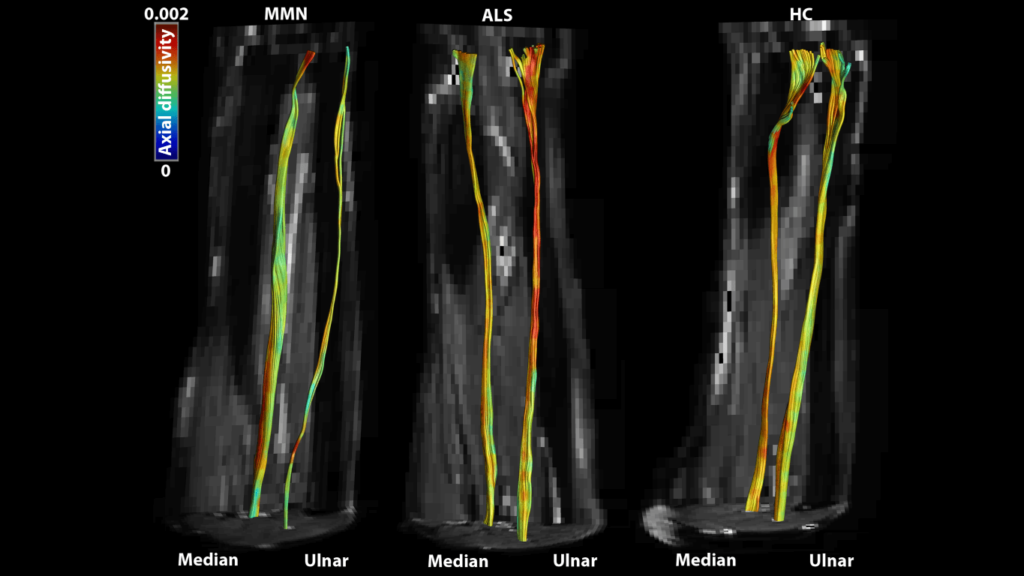
Fiber tractografie van de nervus medianus en nervus ulnaris in een multifocale motor neuropathie (MMN) patiënt (links), in een amyotrofe laterale sclerose (ALS) patiënt (midden) en in een gezonde controle (HC) (rechts) [2]
De resultaten
Niet alle data was kwalitatief goed genoeg om mee te nemen in de analyse (voornamelijk door beweging), waardoor we in totaal 9 armen moesten excluderen van de analyse van de zenuwoppervlakte en 15 armen voor de DTI analyse. Oppervlaktemetingen lieten zien dat de oppervlakte in MMN patiënten circa 25-30% groter is dan bij ALS of bij gezonde personen (zie Figuren 3 en 4). Dit zou te maken kunnen hebben met veranderingen die plaatsvinden in het myeline wat om de zenuw heen zit.
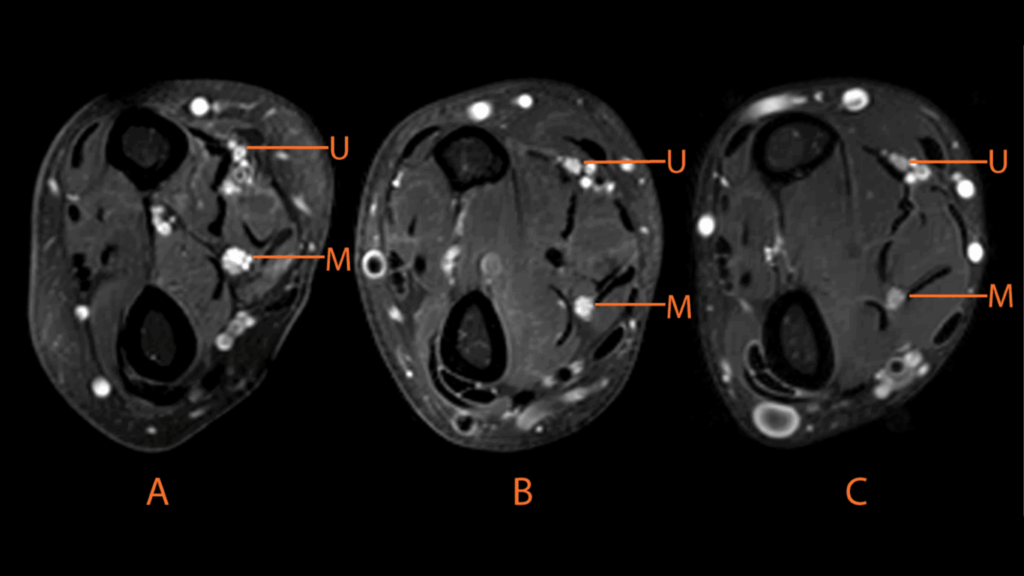
T2 MRI scans van de onderarm bij patiënten met MMN (A), ALS (B) en gezonde controle (C) waarbij te zien is dat de nervus medianus (M) en nervus ulnaris (U) verdikt zijn in de MMN patiënt [2]
Daarnaast hebben we gekeken naar de diffusieparameters. Hoewel FA, MD en RD niet veranderen over de gehele zenuw, vonden we wel een verlaging van de AD in zenuwen bij MMN (2.20±0.12 ×10-3 mm²/s) in vergelijking met ALS (2.31±0.17 ×10-3 mm²/s; p<0.05) en controles (2.31±0.17 ×10-3 mm²/s; p<0.05). De AD (de diffusie georiënteerd langs de zenuw) wordt vaak geassocieerd met axonale schade. We verwachten dat een lagere AD in MMN patiënten te maken heeft met het verlies van axonen in de zenuw. Dit geeft ons weer iets meer informatie over de pathologie, waardoor we de ziekte beter kunnen begrijpen.
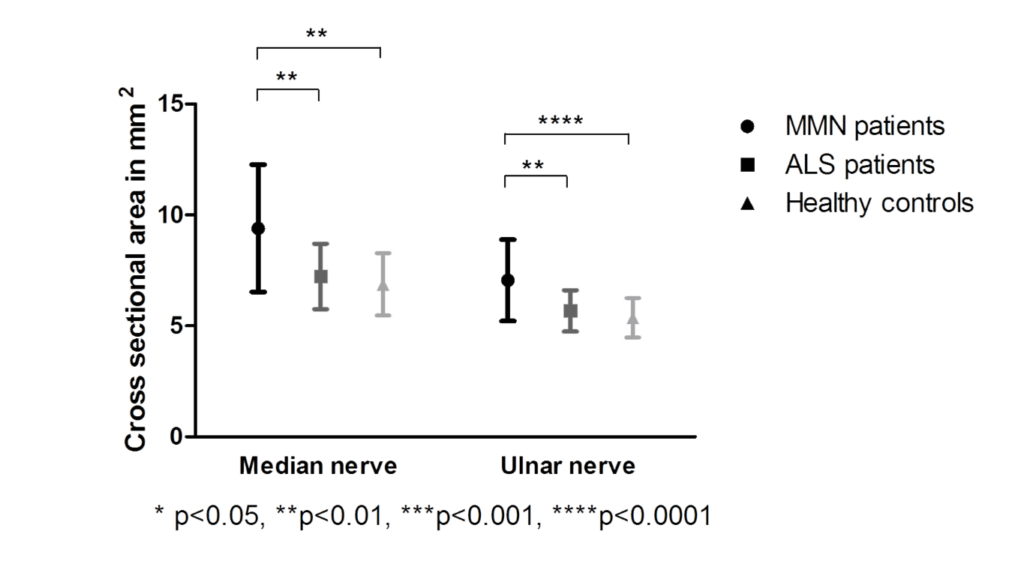
Boxplots van de zenuwoppervlakte in patiënten met MMN, ALS en gezonde controles, waarbij een grotere zenuwoppervlakte te zien is in de patiënten met MMN t.o.v. ALS en gezonde controles [2]
De toekomst
De resultaten van ons onderzoek laten zien dat MRI en DTI een belangrijke bijdrage zouden kunnen leveren aan het diagnosticeren en in kaart brengen van verschillende zenuwziekten. Wel valt er nog winst te behalen in hoe we de DTI beelden opnemen. Met name de duur van het onderzoek, waarbij tot wel een uur lang stil moet worden gelegen, is zwaar voor patiënten. We zijn nu ook bezig met het doen van onderzoek naar andere ziektebeelden zoals spinale musculaire atrofie (SMA) waarbij we specifiek naar het ruggenmerg en zenuwen in de nek en uittredende zenuwen kijken. Hierbij onderzoeken we wat de waarde van MRI en DTI zou kunnen zijn voor het meten van de effectiviteit van een behandeling.
Referenties
[1] W. Haakma, “Advances in forensic imaging – CT angiography and diffusion MRI of the nervous system, 2017, PhD dissertation, Aarhus University
[2] W Haakma, et al, “MRI shows thickening and altered diffusion in the median and ulnar nerves in multifocal motor neuropathy”, 2016, European Radiology, 27 (5), 2216-2224, doi 10.1007/s00330-016-4575-0, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5374174/







