Kunstmatige alvleesklier technologie is ontwikkeld om het dagelijks leven van diabetes type 1 patiënten te verbeteren en wordt in de ziekenhuisomgeving ook op de proef gesteld voor patiënten met diabetes type 2. Voor een kunstmatige alvleesklier wordt een door mens gemaakte technologie gebruikt die de echte werking van een alvleesklier nabootst.
Kunstmatige alvleesklier
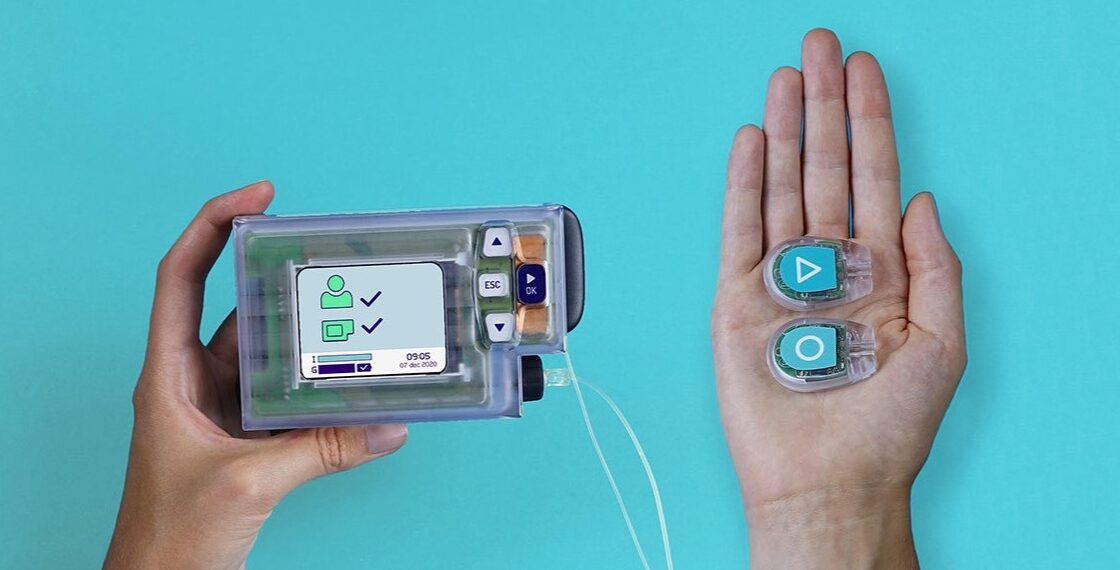
De kunstmatige alvleesklier is een apparaatje met een “alles-in-een” systeem voor diabetes zelfmanagement dat de bloedglucose levels bijhoudt d.m.v. Continue GlucoseMonitoring (CGM) en automatisch het hormoon insuline toedient wanneer dat nodig is met behulp van een insulinepomp. Dit systeem vervangt de afhankelijkheid van bloedglucose meten met een vingerprik en afzonderlijke toediening van insuline via meerdere injecties per dag.

Diabetes Type I en kunstmatige alvleesklier
Diabetes type I is een auto-immuun ziekte waarbij het afweersysteem antilichamen begint te produceren die de eigen insuline-producerende cellen in de alvleesklier aanvallen en vernietigen. Het lichaam is dan niet meer in staat eigen insuline aan te maken, en is zo levenslang afhankelijk van insuline injecties om de bloedsuikerspiegel onder controle te houden. In Nederland zijn er ongeveer 66.000 bij de huisarts bekende Diabetes Type I patiënten.
Type 1 diabetes ontwikkelt zich meestal in de kindertijd. Een van de meest voorkomende risico’s is wanneer de bloedsuikerspiegel veel te laag wordt (hypoglykemie; hypo = laag, glucose = suiker), wat uiteenlopende symptomen kan veroorzaken, waaronder agitatie, verwardheid en veranderd gedrag, dat zich ontwikkelt tot bewustzijnsverlies. Hypoglykemische episoden kunnen vaak ’s nachts en na het drinken van alcohol optreden, waardoor het in bijzonder een risico wordt voor jongeren met diabetes.
Het in stand houden van constante bloedsuikerspiegels is essentieel voor het functioneren van de brein, lever en nieren. Dat wordt normaal gesproken in stand gehouden met behulp van insuline en glucagon (insuline zorgt ervoor dat glucose uit het bloed de cellen in gaat en glucagon het omgekeerde), wat bij mensen met diabetes type I niet werkt. Daarom is het voor type 1-patienten noodzakelijk de suikerlevels in evenwicht te houden wanneer het lichaam zelf geen insuline kan produceren. De endocriene (hormonale) functie van de alvleesklier wordt voorzien door de cellen genaamd de eilandjes van Langerhans die de hormonen insuline en glucagon produceren.
Deze kunstmatige alvleesklier bootst de afgifte van deze hormonen in de bloedbaan na als reactie op de veranderende bloedglucosespiegels in het lichaam. Deze technologie zorgt voor vervangend werking dat normaal gesproken wordt geleverd door een gezonde alvleesklier.

Er zijn drie grootste kunstmatige alvleesklier systemen:
- Closed-loop kunstmatige alvleesklier
- Bionische alvleesklier
- Geïmplanteerde kunstmatige alvleesklier
Closed-loop kunstmatige alvleesklier
De meest geteste kunstmatige alvleesklier is een zogenaamde ‘closed-loop insulinetoedieningssysteem’, of ook wel closed-loop kunstmatige alvleeslier genoemd.
De ‘closed-loop insulinepomp’ is een klein pompapparaatje dat op het lichaam is aangesloten. Het systeem geeft de juiste hoeveelheid hormoon af, dat berekend is uit de metingen van de glucose sensor, die de meetwaarden draadloos naar de pomp verzendt.
De sensor voorziet de insulinepomp software van continue informatie, waarmee het de pomp mogelijk maakt de hoeveelheid afgegeven insuline te reguleren. De insuline wordt toegediend via een onderhuids buisje, waardoor continue injecties worden vermeden.

Bionische alvleesklier
In 2015 werd de iLet op de markt gebracht, een bionische alvleesklier die diabetes type 1 patiënten zou kunnen helpen hun aandoening met slechts één apparaatje te beheren. De bionische alvleesklier, ontwikkeld door de firma Dr Edward Damiano’s Beta Bionics, houdt automatisch de bloedglucosewaarden onder controle, bestaand uit twee pompjes die respectievelijk insuline en glucagon afgeven.
De pompjes worden via Bluetooth met een iPhone app verbonden, waardoor de twee toestellen met elkaar kunnen communiceren om zo de benodigde doses te berekenen. Elke vijf minuten wordt er automatisch een nieuwe dosering bepaald voor zowel insuline als glucagon op basis van bijgewerkte bloedglucosewaarden, die door de glucosemonitor (CGM) gemeten zijn.

Geïmplanteerde kunstmatige alvleesklier
Het implanteerbare insuline toedieningsapparaat is voorzien van een gel die reageert op veranderingen in de bloedglucosespiegels. Het wordt ontwikkeld door onderzoekers van Universiteit De Montfort. Wanneer de bloedglucosespiegels verhoogd zijn, zorgt de gel ervoor dat er meer insuline wordt afgegeven; tijdens lagere suikerniveaus verlaagt de gel de hoeveelheid insuline die het afgeeft. Dit systeem kan op een regelmatige basis worden bijgevuld met insuline.
Gebruik van een ‘kunstmatige alvleesklier’ bij ziekenhuispatiënten met diabetes type 2
Kunstmatige alvleesklier kan ook een gunstige rol spel in bloedglucose regulatie bij diabetes type 2 patiënten die in het ziekenhuis worden opgenomen voor niet-kritieke zorg. Bij type 2-diabetes produceert de alvleesklier wel nog steeds insuline, maar kan deze ofwel niet voldoende insuline produceren, of de cellen in het lichaam zijn minder gevoelig geworden voor dit hormoon, waardoor de aanwezige insuline niet langer voldoende is om de bloedsuikerspiegel adequaat onder controle te houden. Type 2-diabetes wordt meestal gereguleerd d.m.v. een dieet en medicatie, hoewel sommige mensen met slechte ziektecontrole ook uiteindelijk insuline-injecties nodig hebben, zoals mensen met diabetes type 1.
Het aantal patiënten met diabetes type 2 die opgenomen worden neemt toe en de glucoseregulatie verslechtert vaak in de loop van de ziekte. Volgens NIHR, hadden de patiënten die gebruik maakten van deze kunstmatige alvleesklier systemen voor gemiddeld zes uur langer glucose waarden binnen de gewilde bereik. Dit zou gunstig kunnen zijn voor het herstel van de opgenomen patiënten en de werklast van het personeel kunnen verminderen. Er is echter nog meer kosten-batenanalyse nodig.
De bevindingen wijzen aan dat ‘closed-loop’ systemen de glucoseregulatie kunnen verbeteren voor opgenomen patiënten met diabetes type 2. Niettemin zijn er belangrijke praktische overwegingen in dit stadium. Er zou namelijk een groot aantal patiënten mogelijk in aanmerking kunnen komen voor deze behandeling. Daarmee zouden de kosten flink oplopen en et is nog onduidelijk in hoeverre dit zou vertalen in minder ziekenhuisverblijf en minder complicaties.
https://www.ebme.co.uk/articles/clinical-engineering/artificial-pancreas