In hun opleiding wordt tandartsen geleerd dat ze alert moeten zijn wanneer de adem van patiënten naar aceton ruikt. Dat heeft niets te maken met de mond of tanden, maar de lucht van aceton is een sterke indicator voor diabetes. Als gevolg van een tekort aan insuline kunnen cellen geen glucose opnemen terwijl ze wel energie nodig hebben. Het lichaam gaat dan over op de verbranding van vetten, waarbij ketonen als aceton vrijkomen. Dit voorbeeld toont hoe een uitgeademde metaboliet kan fungeren als biomarker. Het vakgebied dat zich hiermee bezig houdt wordt Breathomics genoemd. De focus ligt daarbij op het verzamelen, identificeren en kwantificeren van (patronen van) vluchtige organische componenten (VOCs) in de uitademingslucht. Vervolgens kunnen deze VOCs gerelateerd worden aan ziekten en toepassing vinden in nieuwe non-invasie diagnostische testen.
Inleiding
In hun opleiding wordt tandartsen geleerd dat ze alert moeten zijn wanneer de adem van patiënten naar aceton ruikt. Dat heeft niets te maken met de mond of tanden, maar de lucht van aceton is een sterke indicator voor diabetes. Als gevolg van een tekort aan insuline kunnen cellen geen glucose opnemen terwijl ze wel energie nodig hebben. Het lichaam gaat dan over op de verbranding van vetten, waarbij ketonen als aceton vrijkomen.
Dit voorbeeld toont hoe een uitgeademde metaboliet kan fungeren als biomarker. Het vakgebied dat zich hiermee bezig houdt wordt Breathomics genoemd. De focus ligt daarbij op het verzamelen, identificeren en kwantificeren van (patronen van) vluchtige organische componenten (VOCs) in de uitademingslucht. Vervolgens kunnen deze VOCs gerelateerd worden aan ziekten en toepassing vinden in nieuwe non-invasie diagnostische testen.
De basis van uitademingslucht als diagnostische test is al een eeuwen oud concept. Hippocrates leerde zijn studenten al dat geur een arts van nuttige informatie kan voorzien. Zo verspreidt een leverpatiënt soms een vislucht en kan een longabces een riool-achtige lucht veroorzaken.
Onze uitgeademde lucht bestaat voor het belangrijkste deel uit stikstof, zuurstof, kooldioxide en water. Echter in de jaren zeventig van de vorige eeuw toonde Nobelprijs winnaar Linus Pauling door middel van temperatuur geprogrammeerde gaschromatografie aan dat adem, in zeer kleine concentraties, een complexe en relatief stabiele mix van VOCs bevat. De laatste woorden in het abstract van het artikel dat hij hier aan wijde waren: “This technique should be useful in the application of the principles of orthomolecular medicine”. Waarmee hij één van dé grondleggers van het vakgebied is.
Gaschromatografie massaspectrometrie vs. eNose
De wijze waarop ademsamples geanalyseerd worden, kan grofweg in twee stromingen worden verdeeld. Als eerste gaschromatografie massaspectrometrie (GC/MS); een chemische analytische methode die sterk lijkt op de methodieken die Pauling toepaste. Hierbij wordt gekeken welke componenten zich nu precies in een sample bevinden, door deze te scheiden op basis van temperatuur, massa en/of ionisatie. Dit is erg is interessant wanneer het gaat over bijvoorbeeld het ontdekken of ontrafelen van pathofysiologische mechanismen. GC/MS wordt vaak gezien als “de gouden standaard” binnen het vakgebied.
De tweede Breathomics stroming is gebaseerd op gassensor-technologie en wordt met behulp van een electronische neus (eNose) verricht. De eerste onderzoekers die melding maakten van deze techniek waren Krishna Persaud en George Dodd in 1982 in het blad Nature met hun onderzoek naar het humane olfactorische systeem. Zij veronderstelden dat de menselijke reuk niet gebaseerd is op zeer specifieke receptoren, maar op een combinatie van breed gevoelige receptoren, met neuronen als slimme signaal verwerkers en de hersenen als referentie database. Om deze hypothese te testen ontwikkelden zij een elektronische neus op basis van halfgeleider sensoren. Niet alleen het concept van de elektronische neus bleek te werken; in 1991 toonden Axel en Buck met Nobelprijs winnend onderzoek aan dat het principe achter humane reuk systeem gelijk is aan het concept van de elektronische neus van Persaud en Dodd.
Kijkend naar de voor- en nadelen, wint GC/MS op het gevoeligheid en de mogelijkheid tot pathofysiologische onderbouwing en de eNose op de lage kosten, eenvoud en toepasbaarheid in de klinische praktijk.
Midden jaren tachtig verschenen al de eerste publicaties rondom uitademingslucht, GC/MS en longkanker. Echter, meer computer capaciteit, betere GC/MS scheidingsmethodes, verdere ontwikkeling van de sensor technologie en nieuwe statistische technieken brachten eind jaren 90 het vakgebied in een stroomversnelling. Kijkend naar publicaties op het gebied van longziekten bleek het niet alleen mogelijk op basis van uitgeademde lucht onderscheid te maken tussen gezonde proefpersonen en patiënten met astma, COPD of longkanker. Ook binnen deze ziekten blijken subgroepen waarneembaar. Zo zijn er de eerste tekenen dat het mogelijk is om een respons op medicatie te voorspellen en om te ‘ruiken’ wat voor een type luchtwegontsteking iemand heeft.
De SpiroNose
“Gelet op kosten, eenvoud en toepasbaarheid in de klinische praktijk heeft eNose technologie in vergelijk met GC/MS het grootse potentieel om zich te ontwikkelen tot een snelle, niet-invasieve diagnostische toepassing. Daarbij kan gedacht worden aan screening voor longkanker, maar ook aan het monitoren en/of voorspellen van astma en COPD exacerbaties. In die hoedanigheid zou het concept doorontwikkeld kunnen worden tot een standalone tool, maar ook integratie met bestaande longfunctie apparatuur is een goede optie.” Met deze gedachten als uitkomst van een vakgroep overleg, begonnen wij 3 jaar geleden met het testen van eNose sensoren gekoppeld aan een standaard longfunctie apparaat, de spirometer.
Met een spirometer wordt via een aantal standaard manoeuvres de longinhoud van een patiënt gemeten. Het plaatsen van sensoren direct achter dit apparaat bleek succesvol en resulteerde in de ontwikkeling van de SpiroNose: een electronische neus die makkelijk geïmplementeerd kan worden in de dagelijkse longfunctie onderzoeken.
Momenteel wordt de SpiroNose getest in het BreathCloud studie (www.breathcloud.org). Een project opgezet door het Academisch Medisch Centrum Amsterdam (AMC) in samenwerking met het Longfonds, Pontes Medical, Comon Invent B.V. en mede mogelijk dankzij de deelnemers van de Vriendenloterij. Daarnaast reeds ondersteund door VUmc, NKI-AVL, MST Enschede, Franciscus gasthuis Rotterdam.
Werkingsprincipe
Sensoren
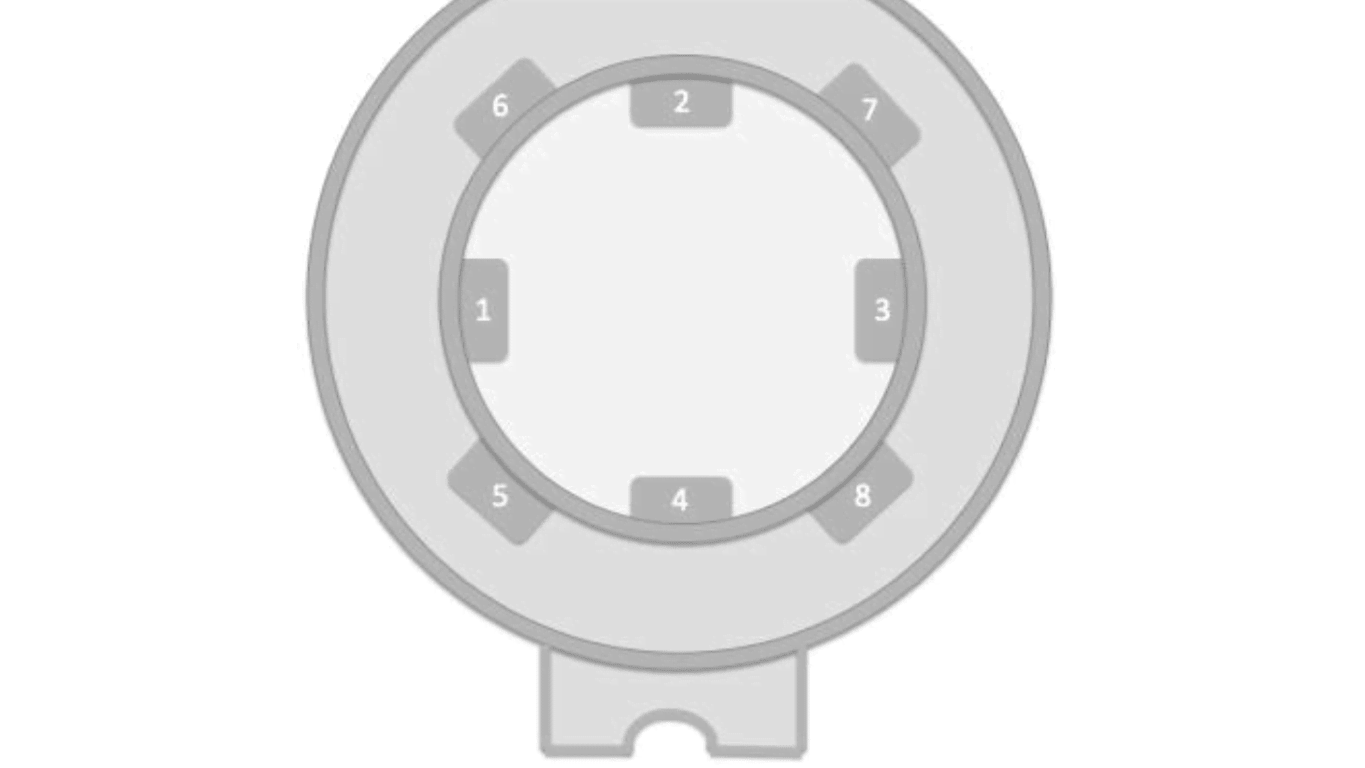
De SpiroNose [Figuur 1a] bestaat uit 4 sensor modules van 4 metaaloxide sensoren voor de ademanalyse en 4 modules voor het monitoren van de omgeving. Uit eerder onderzoek is gebleken dat omgevingslucht veel invloed heeft op de kwaliteit van de resultaten. Correctie voor dit signaal is daarom essentieel.
In totaal bevat de SpiroNose 8 verschillende sensoren, wat resulteert in een duplo meting van zowel de uitgeademde lucht als de omgevingslucht. Via een ethernetkabel wordt de sensor data real-time en anoniem verstuurd naar een server.
Meting
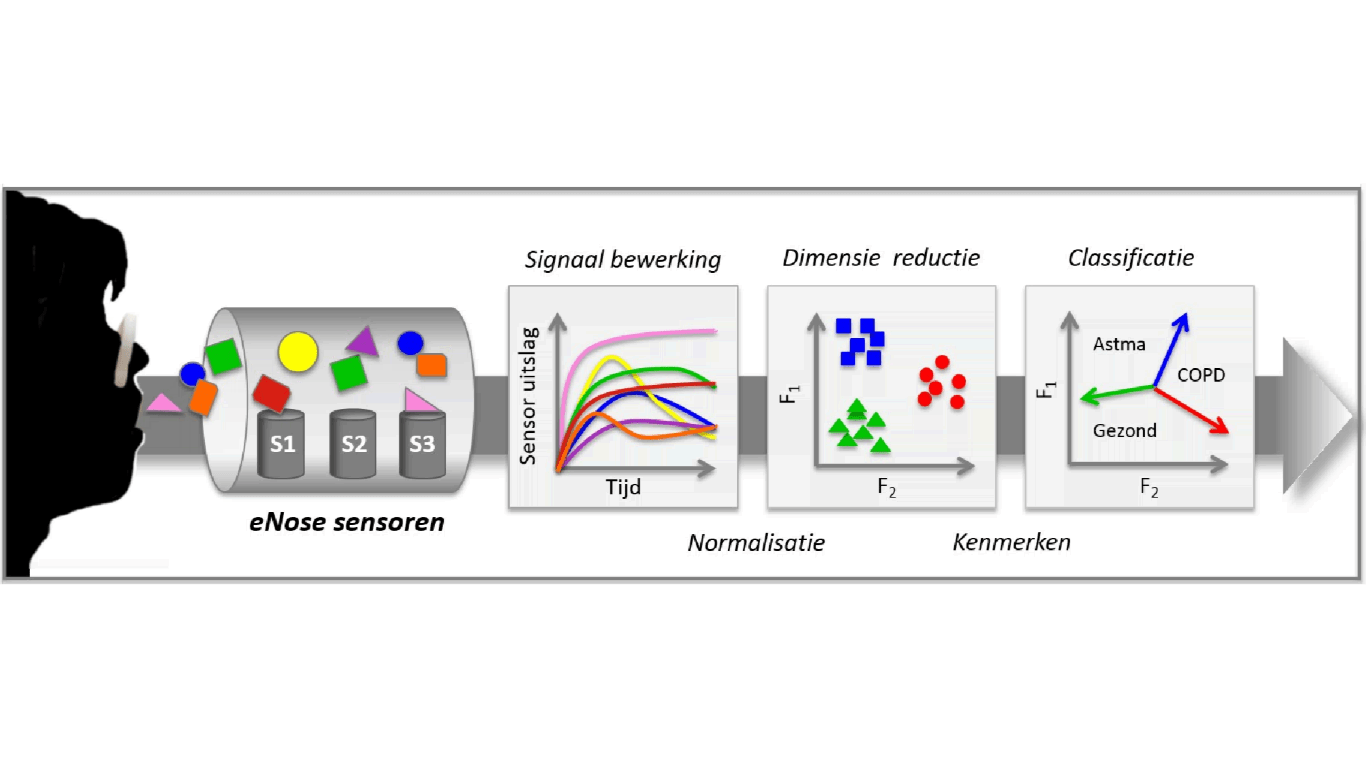
Stap 1: De patiënt ademt diep in en rustig uit door het longfunctie apparaat. Stoffen aanwezig in de uitademingslucht, worden door de eNose sensoren gemeten. [Figuur 1b + 2]
Stap 2: De sensoren reageren op de uitademingslucht van de patiënt. Elke sensor op een andere manier, want elke sensor is gevoelig voor een andere serie van stoffen. [Figuur 2: eNose sensoren]
Stap 3: Om van de SpiroNose sensorsignalen te komen tot een uiteindelijk uitademingsprofiel (breathprint), is een reeks aan signaalbewerkingen en statistiek benodigd. Na filtering en correctie voor omgevingslucht, worden de sensor uitslagen genormaliseerd en met behulp van principale componenten analyse gereduceerd tot een kleinere set variabelen die nog steeds een grootste deel van de variantie in de data bevatten. Deze techniek wordt onder andere toegepast om het risico op “false discoveries” te verkleinen, hetgeen van belang is bij dit soort multidimensionale analyses. [Figuur 2: Signaal bewerking + Dimensie reductie]
Stap 4: De gevormde principale componenten vormen de basis voor de uiteindelijke verdere vergelijkingen tussen patiëntgroepen, hetgeen doormiddel van student t test, mann-whitney u test, lineaire discriminant analyse en/of AUC-ROC curves gedaan wordt. [Figuur 2: Classificatie]
Breathcloud studie
De Breathcloud studie, is het project waarin de SpiroNose getest wordt in de dagelijkse praktijk. Op dit moment wordt er gewerkt aan een online database, welke gevuld wordt met breathprints van goed gekarakteriseerde patiënten uit verschillende de perifere en academische partner ziekenhuizen. Deze database is gekoppeld aan het computerprogramma “BreathCloud” dat gebaseerd is op kunstmatige intelligentie. In het tweede deel van de studie, zal de accuraatheid van Breathcloud gevalideerd worden op een nieuwe groep patiënten uit de 1e, 2e en 3e -lijns zorg.
De toekomst
Bij succesvolle resultaten uit de Breathcloud studie is er waarschijnlijk een essentiële stap gezet richting de toepassing van eNose technologie (SpiroNose) in de dagelijkse klinische praktijk. Zo gezegd zou dat kunnen leiden tot de eerste “zwart-wit televisie”, maar uiteindelijk willen we richting een “4K flatscreen”. Essentieel daarbij is de ontwikkeling van nieuwe sensoren. De huidige SpiroNose is gebaseerd op aspecifieke “off-the-shelf” sensoren, maar nieuwe VOC specifiekere sensoren zullen een belangrijke rol gaan spelen in de ontwikkeling van de 2e en 3e generaties SpiroNose. Ook op dit punt is de input vanuit het GC/MS onderzoek dus van groot belang.
De link tussen uitgeademde lucht en longziekten ligt natuurlijk voor de hand, maar naast experts op het gebied van longziekten beginnen ook maag-darm-leverartsen steeds meer belangstelling te tonen. Ook in dat specialisme zijn al enkele mooie publicaties rondom ‘geur’ verschenen.
Slimme, niet dure, laagdrempelige en breed inzetbare spreekkamertechnologie is de toekomst van de gezondheidszorg. eNose technologie past binnen dit perspectief. Wanneer deze trend zich doorzet is de volgende die aan zet is de patiënt zelf: met een eNose en een App in zijn eigen smartphone. Dan is diagnose in één adem heel dichtbij!