Als je hard valt en je armen uitsteekt om de val op te vangen dan loop je het risico je pols te breken. Meestal breekt dan het spaakbeen (radius) omdat het distale deel van het bot, dat zit het dichtst bij de pols, relatief zwak is. Vaak wordt het bot een stukje in elkaar gedrukt. Het komt daardoor in een verkeerde stand terecht. In het ziekenhuis wordt geprobeerd het bot weer op zijn plaats te krijgen waarna de onderarm in gips wordt gezet. In 5% van de gevallen staat het bot na herstel echter nog flink verkeerd waardoor de patiënt klachten ondervindt bij het gebruik van de pols. In die gevallen volgt correctiechirurgie, waarbij het bot wordt doorgezaagd (osteotomie) en de twee botdelen weer in de oorspronkelijke stand worden vastgezet met een metalen plaat en schroeven.
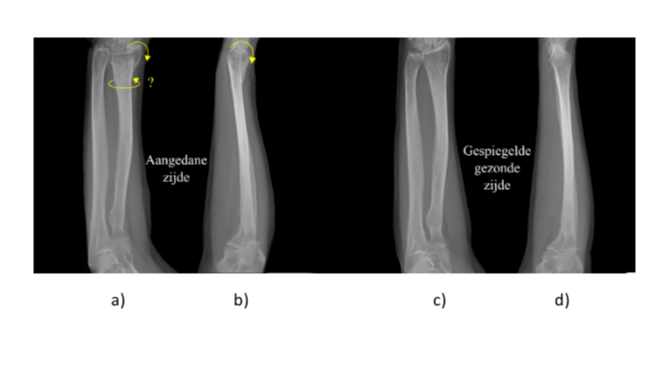
Dat klinkt eenvoudig maar is niet zo’n makkelijk klusje [1]. In de meeste ziekenhuizen wordt een correctie osteotomie vooraf gepland aan de hand van Röntgenfoto’s, één foto genomen vanaf de handrug-zijde, de andere vanaf de zijkant van de pols (Fig. 1). Uit elk van deze foto’s schat de chirurg de hoek in waarover hij het distale bot terug moet kantelen. Ook schat hij in of het bot iets moet worden verlengd om weer de juiste hoogterelatie te krijgen met de ellepijp (ulna), het andere bot in de onderarm. De chirurg schat dus twee hoeken in, en een verlenging. De uitdaging is verder dat hij op de juist plek moet zagen en de botdelen in de juiste stand moet zetten terwijl hij, door de kleine incisie, geen goed zicht heeft op de inwendige botstructuren.
Met een fixatieplaat (Fig. 2a) en schroeven worden de botsegmenten in de verkregen stand gehouden. In veel gevallen is het bot echter ook gedraaid rond de lengte-as. En die draaiing is niet zichtbaar op de Röntgenfoto’s. Eigenlijk is het ook een drie-dimensionaal (3D) probleem waarbij de chirurg een verschuiving en een verdraaiing in elk van de drie dimensies moet corrigeren. Bovendien wordt de osteotomie vaak gekozen op de breuklijn, terwijl het bot wat kan zijn gedeformeerd, en een andere plek van de zaagsnede tot een beter resultaat kan leiden [5]. Kortom er valt wat aan de methode te verbeteren. Door J.G.G. Dobbe (1), M.G. de Roo (2), S.D. Strackee (2) en G.J. Streekstra (1) 1Afdeling Biomedical Engineering and Physics 2Afdeling Plastische, reconstructieve en handchirurgie Amsterdam UMC, locatie AMC.
Nieuwe methodiek
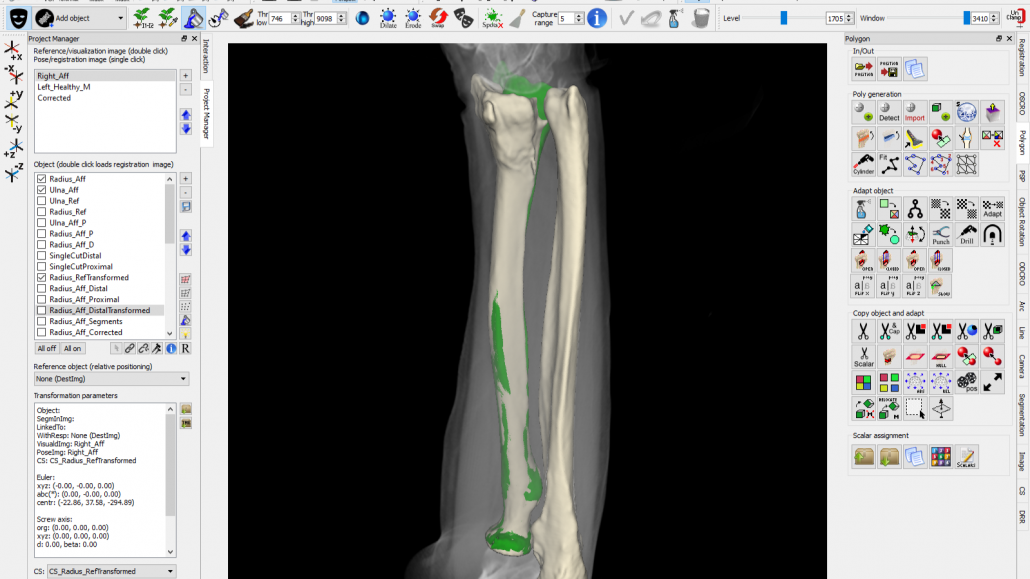
In het Amsterdam UMC vindt sinds 2009 onderzoek plaats rond reconstructie van verkeerd aangegroeide botten op basis van 3D CT beelden. Het doel is inzicht te krijgen in de beperkingen van de conventionele methode [1][2] en om middelen aan te reiken waarmee de oorspronkelijke stand zo goed mogelijk kan worden hersteld. Om de foutstand van het bot in 3D te plannen is software geschreven [3][4][5] waarmee vóór de operatie een virtuele planning -dus op het computerscherm- kan worden gemaakt op basis van zo’n 3D CT beeld (Fig. 3). Tijdens die planning wordt de aangedane radius eerst gesegmenteerd. Dat is een methode waarmee uit het grijstintenbeeld van een CT scan een 3D model van het bot wordt verkregen.
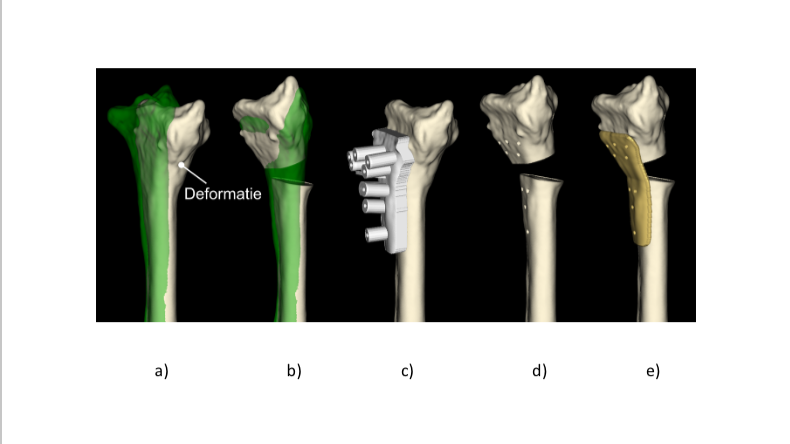
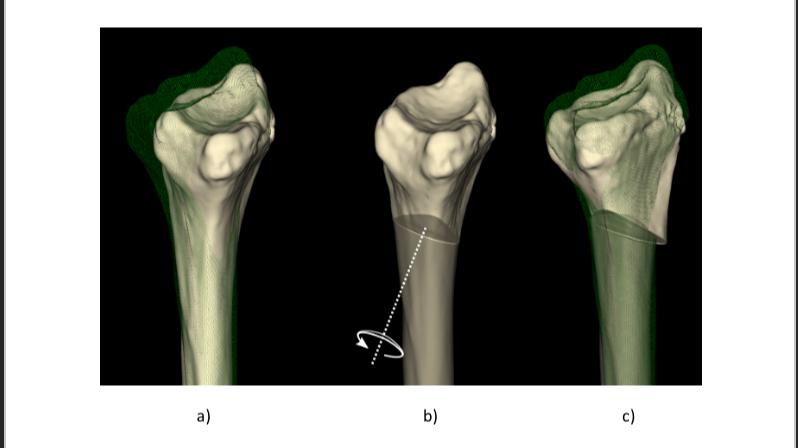
Bij het maken van de CT scan wordt ook de gezonde zijde van de patiënt gescand. Dat wordt gedaan omdat er relatief kleine links-rechts verschillen blijken te zijn, en de andere zijde -na spiegeling- dus een goede referentie is van hoe de radius eruit moet komen te zien. Door nu de virtuele 3D modellen van de aangedane en referentieradius aan de onderzijde (proximaal) op elkaar uit te lijnen, kan goed zichtbaar worden gemaakt hoe sterk het bot is gedeformeerd (Fig. 3 en Fig. 4a). Door nu het distale botdeel virtueel door te zagen en over de andere kant te leggen (Fig. 4b), kan ook worden uitgerekend hoe dat botdeel moet worden verschoven en gedraaid in elk van de drie dimensies, om het weer op zijn plaats te krijgen. Hierbij moet soms worden gecorrigeerd voor het lengteverschil dat tussen links en rechts bestaat [2]; vandaar dat het distale deel iets hoger staat dan het groene referentiebot.
Van virtueel 3D plan naar de echte patiënt
Mooi dat het op die manier prima virtueel kan worden gecorrigeerd. Maar hoe vertaalt de chirurg nu dat virtuele plan naar de werkelijke patiënt? In het verleden is gebruik gemaakt van optische navigatiesystemen met camera’s en speciale instrumenten voor in de operatiekamer. De camera’s bekijken waar die speciale instrumenten zich in de ruimte bevinden en laten de instrumenten in de virtuele wereld zien, dus op het computerscherm samen met de virtuele botten.
Zo ziet de chirurg op het scherm waar hij de zaag op het werkelijke bot plaatst en als dat klopt met de eerdere planning, dan kan het zagen beginnen. Navigatiesystemen zijn duur, nemen veel ruimte in, zijn ingewikkeld in gebruik, en de nauwkeurigheid ervan hangt van een hoop zaken af. Zoals de afstand van de camera’s tot de patiënt, en van de nauwkeurigheid waarmee het virtuele bot aan het werkelijke bot is gekoppeld (de zgn. registratie).
Navigatie dankzij 3D printers
Het Amsterdam UMC maakt al lange tijd gebruik van 3D printers om botmodellen uit te printen. Dat geeft inzicht in de aandoening en maakt het ook makkelijker om de problematiek met de patiënt te bespreken. Voor botcorrecties worden geen optische navigatiesystemen gebruikt maar 3D geprinte mallen [6] die passen op de specifieke anatomie van de patiënt (Fig. 4c). De mal past alleen op het bot op de locatie die tijdens de virtuele planning is gekozen.
Door tijdens de planning een plek te kiezen voor de zaagsnede en op die plek een sleufje in de mal op te nemen, kan tijdens de operatie door de werkelijke sleuf worden gezaagd als de mal op zijn plaats zit. Zo zaagt de chirurg exact op de gewenste plek en in de goede richting. Om ook de botdelen goed te kunnen plaatsen wordt soms gebruik gemaakt van een patiënt-specifieke fixatieplaat (Fig. 4e) [4]. Zo’n ‘plaat-op-maat’ is ontworpen om exact te passen op de doorgezaagde bothelften. Via de schroefgaten in die plaat worden de bothelften vastgeschroefd in exact de vooraf geplande stand [6].
Via cilindertjes in de zaagmal kan de chirurg daartoe eerst gaatjes in het bot voorboren (Fig. 4b) alvorens het bot door te zagen. Patiënt-specifieke hulpmiddelen zijn relatief eenvoudig in gebruik en de kunststof varianten zijn bovendien vrij goedkoop te produceren. Uit verschillende onderzoeken is gebleken dat operaties met patiënt-specifieke hulpmiddelen nauwkeuriger zijn en sneller verlopen dan zonder die hulpmiddelen.
Schuin zagen
Dankzij het onderzoek in het Amsterdam UMC zijn ook andere handige methodes gevonden om botcorrecties beter uit te voeren. Bij het herpositioneren van het ene t.o.v. het andere botdeel ontstaat doorgaans een ruimte tussen de botdelen (Fig. 4b). Immers, het bot was tijdens de breuk wat ingezakt wat de positionering veranderde. Soms wordt dat ‘defect’ opgevuld met donorbot of een stukje bot uit de heup. De doorbloeding van het bot is hiermee echter niet optimaal en soms heeft men liever verlenging van het bot zonder defect.
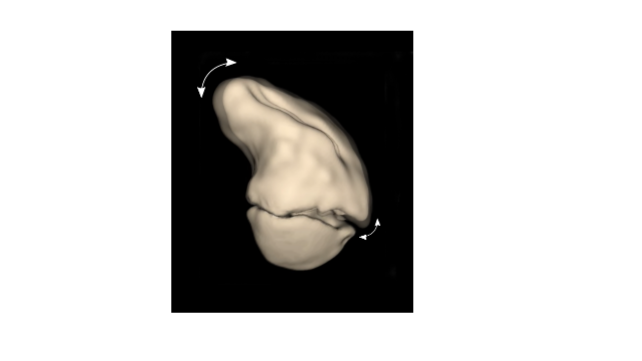
Dat klinkt als onmogelijk maar toch kan het vaak, door gebruik te maken van een schuine zaagsnede [5]. De truc hierbij is dat na schuin zagen het distale botsegment wordt gedraaid terwijl de contactvlakken van de bothelften op elkaar blijven (Fig. 5). Door het draaien zwiepen de botdelen in de juiste stand. Door bovendien de botdelen in het contactvlak iets t.o.v. elkaar af te schuiven kan verlenging worden verkregen. Bij deze methode is het wel belangrijk dat de oriëntatie van het zaagvlak, de rotatie van het distale botdeel en de eventuele verschuiving in het zaagvlak goed worden uitgerekend. Daartoe is in het Amsterdam UMC speciale software gemaakt die correctie via een schuine zaagsnede helemaal doorrekend [5].
Met behulp van mallen kan deze methode vervolgens weer van het virtuele bot in de computer naar het werkelijke bot van de patiënt worden overgebracht. Als de botten erg gedeformeerd zijn is het zelfs mogelijk m.b.v. twee schuine zaagsneden en botrotaties de optimale uitlijning en positionering te bereiken. Ook voor een dergelijke aanpak is software ontwikkeld.
Beweging onderzoeken met 4D beelden
De bovengenoemde methoden maken gebruik van 3D beeldvorming wat al een enorme verbetering is ten opzichte van de veelgebruikte 2D beeldvorming. In sommige gevallen is echter zelfs 3D niet toereikend. Bijvoorbeeld wanneer een aandoening zich alleen uit bij beweging. Zo kunnen bij een breuk van het scaphoid, een van de handwortelbeentjes, de twee bothelften niet goed aan elkaar groeien. Dat loszitten van die bothelften kan aan de hand van een Röntgenfoto of CT scan soms niet worden vastgesteld. Door nu een hele serie 3D plaatjes van een langzaam bewegende pols achter elkaar te maken ontstaat een zogenaamd 4D beeld.
Als de helften van een gebroken scaphoid niet aan elkaar zijn gegroeid, kun je zien dat die helften bij een bewegende pols ten opzichte van elkaar bewegen (Fig. 6). Zelfs de kleinste bewegingen kunnen op die manier worden vastgesteld waardoor met hoge zekerheid kan worden bepaald of de helften zijn vastgegroeid of niet [7]. Zo kan slijtage worden voorkomen van niet alleen de bothelften van het scaphoid maar ook van omringende polsbotjes en uiteindelijk van de hele pols.
Discussie
Het gebruik van 3D beeldvorming en beeldanalyse voor correctiechirurgie van verkeerd aangegroeide botten wordt in de meeste ziekenhuizen nog niet toegepast. De aanpak met 2D beelden gaat gelukkig vaak goed, maar kent zeker zijn beperkingen. Voor complexe deformaties grijpt het Amsterdam UMC daarom regelmatig naar 3D beeldvorming en beeldanalyse. Dankzij de nieuwe ontwikkelingen, zoals de schuine osteotomie, 3D geprinte mallen en patiënt-specifieke implantaten, kunnen de botcorrecties steeds beter worden uitgevoerd. En dat blijkt ook erg belangrijk te zijn [1], want het is aangetoond dat er een relatie is tussen foutstand en restklachten, zoals pijn en beperkte functie van de pols. En dat is ook niet verwonderlijk als je beseft dat patiënten naar het ziekenhuis komen juist omdat ze klachten hebben die verband houden met een foute botstand.
Het gebruik van 4D beeldvorming om beweging zichtbaar te maken is nieuw in de diagnose van aandoeningen van het bewegingsapparaat. Het vereist specifieke radiologische kennis om de beelden te kunnen maken, en specifieke software om die beelden te analyseren voor het komen tot een diagnose. Het Amsterdam UMC loopt voorop in deze nieuwe aanpak. Het levert mooie kansen voor onderzoek en voor de patiënt, die met chronische klachten blijft rondlopen omdat de huidige statische beeldvorming niet tot de juiste inzichten leidt, waardoor een goede diagnose niet kan worden gesteld.
Referenties
[1] Vroemen J.C., Dobbe J.G.G., Strackee S.D., Streekstra G.J., “Position evaluation of corrective osteotomy for the malunited radius: 3-D CT versus 2-D radiographs.”, Journal of Orthopedics, 36:2, e193-e199, 2013. doi:10.3928/01477447-20130122-22
[2] Vroemen J.C., Dobbe J.G.G., Jonges R., Strackee S.D. Streekstra G.J., “Three-dimensional assessment of bilateral symmetry of the radius and ulna for planning corrective surgeries.”, Journal of Hand Surgery, 37A:982-988, 2012.Vroemen. doi: 10.1016/j.jhsa.2011.12.035
[3] Dobbe J.G.G., De Roo M.G.A., Visschers J.C., Strackee S.D., Streekstra G.J., “Evaluation of a quantitative method for carpal motion analysis using clinical 3D and 4D CT protocols.”, IEEE Transactions on Medical Imaging, 38(4):1048-1057, 2019. doi: 10.1109/TMI.2018.2877503
[4] Dobbe J.G.G., Vroemen J.C., Strackee S.D., Streekstra G.J., “Patient-tailored plate for bone fixation and accurate 3D positioning in corrective osteotomy.”, Medical and Biological Engineering and Computing, 51(1), 19-27, 2013. doi: 10.1007/s11517-012-0959-8
[5] Dobbe J.G.G., Strackee S.D., Streekstra G.J., “Minimizing the translation error in the application of a single-cut oblique rotation osteotomy: Where to cut?”, IEEE Transactions on Biomedical Engineering, 65(4):821-827, 2018. doi:10.1109/tbme.2017.2721498
[6] Dobbe J.G., Vroemen J.C., Strackee S.D., Streekstra G.J., “Patient-specific distal radius locking plate for fixation and accurate 3-D positioning in corrective osteotomy: Case report.”, Strategies for Trauma and Limb Reconstruction, 9(3):179-183, 2014. doi:10.1007/s11751-014-0203-1
[7] De Roo M.G.A., Dobbe J.G.G., Van der Horst C.M.A.M., Streekstra G.J., Strackee S.D., “Carpal kinematic changes after scaphoid nonunion: an in vivo study with four-dimensional CT imaging.”, Journal of Hand Surgery European, 44(10):1056-1064, 2019. doi: 10.1177/1753193419866598