Met de publicatie van het convenant “Veilige toepassing van medische technologie in het ziekenhuis” in 2011 [1] laaide ook de discussie over het uitvoeren van Prospectieve Risico Inventarisaties (PRI’s) op. Binnen de ziekenhuizen en beroepsverenigingen ontstonden er diverse vragen, zoals: “Op welk moment dienen PRI’s uitgevoerd te worden?”, “Voor welke medische hulpmiddelen dienen de PRI’s uitgevoerd te worden?”, “Welke methode(s) zijn er om PRI’s uit te voeren? ” en “Welke functionarissen dienen de PRI uit te voeren?”. Vanwege de bovenstaande onduidelijkheden besloot de Koepel Medische Technologie een werkgroep op te richten. Deze “Werkgroep Introductie van Nieuwe Technologieën (WINT)” kreeg de opdracht om een praktische handreiking voor de introductie van nieuwe medische technologieën aan te bieden.
Inleiding
Het doel van het WINT document is het geven van een praktische handreiking aan ziekenhuizen met betrekking tot het opstellen en implementeren van procedure(s) omtrent risicomanagement ten behoeve van het veilig toepassen van medische hulpmiddelen gedurende de gehele levenscyclus. Hierbij ligt de focus met name op het ‘prospectief’ inventariseren van de risico’s van zowel :
A) een (voor het ziekenhuis ) nieuw medische hulpmiddel en
B) een reeds bekend medisch hulpmiddel in een nieuwe toepassing.
Gevolgd werkproces
In september 2013 is de werkgroep met een eigen inventarisatie van de reeds beschikbare en bruikbare informatie gestart. Deze inventarisatie bestond uit het verzamelen en doornemen van documenten rondom aanschafprocedures, aanschafdossiers en risicoanalysemethoden die in diverse ziekenhuizen reeds aanwezig zijn. Vervolgens zijn ook bestaande normen, richtlijnen en PRI-methodieken doorgenomen door de werkgroep. Dit heeft geleid tot een handreiking ten behoeve van het uitvoeren van PRI’s binnen het domein van medische technologie.
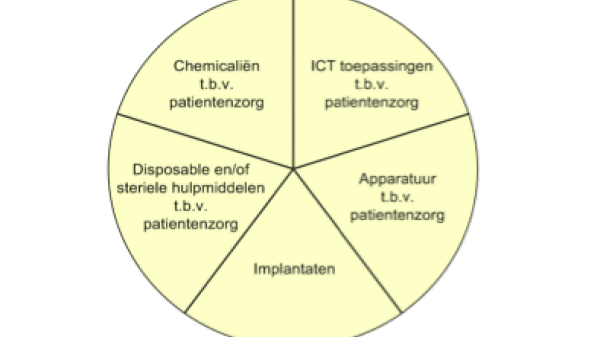
Voor de bepaling van de scope, het gebied van “medische hulpmiddelen”, is gebruik gemaakt van het cirkeldiagram voor medische hulpmiddelen (zie Figuur 1).
Kort na de publicatie van het WINT document is er in februari 2015 een pilottraining georganiseerd voor geïnteresseerden. Het doel van deze pilot was het toetsen van de werkwijzen zoals beschreven in het WINT document en het verkrijgen van tips en tricks ten behoeve van eventuele vervolgtrainingen. Tijdens deze pilot zijn, op basis van de in het WINT document opgenomen voorbeelden, een tweetal praktische exercities op medische apparaten (bloedverwarmer en infuuspomp) uitgevoerd. Hierbij is gebruikgemaakt van de HFMEA methode uit het UMCG en de methode uit het JBZ (zie ook artikel: “Prospectieve risico inventarisatie voor medische apparatuur; een efficiënte aanpak” elders in deze editie van MT Integraal).
Aangezien ziekenhuizen verschillen in o.a. organisatiestructuur en beleidsvoering was het voor de werkgroep vrijwel onmogelijk om een pasklare oplossing te bieden die direct toepasbaar is in alle ziekenhuizen. Daarom blijft voor de invoering en borging van risicomanagement zoals beschreven in het Convenant “Veilige Toepassing van Medische Technologie in het ziekenhuis” een eigen interpretatie van de handreiking nodig door de instellingen zelf.
Risicomanagement
Eén van de valkuilen die de werkgroep heeft geconstateerd, is dat bij het kiezen van een risicomanagement model er vaak naar de meest uitgebreide en optimale versie wordt gezocht. Daarnaast wordt er soms dankbaar gebruik gemaakt van de modellen van collega ziekenhuizen, maar wordt het model niet verder geoptimaliseerd voor de eigen situatie. De werkgroep heeft ook geconstateerd dat een input vanuit diverse disciplines (medici, technici, ICT-ers, Inkoop, etc.) het meest belangrijke onderdeel van de PRI is om tot een overzicht van mogelijke risico’s te komen.
De ISO 31010 is een ondersteunende richtlijn bij het gebruik van de ISO 31000 en geeft verschillende methodieken voor risicobeoordeling zoals Bow-tie, FTA, HACCP en (H)FMEA. Welke methodiek in een gegeven situatie het beste gebruikt kan worden, hangt van verschillende factoren af, zoals:
- De complexiteit van het probleem en de benodigde methoden om die te kunnen analyseren.
- De aard en mate van onzekerheid van de risicobeoordeling gebaseerd op de beschikbare informatie en de informatie die nodig is om aan gestelde criteria te voldoen.
- De omvang van de benodigde middelen in termen van tijd, kennisniveau, informatiebehoefte en kosten.
- De mate waarin de methode een kwantitatieve output kan opleveren.
Specifiek voor risicomanagement voor de veilige toepassing van medische hulpmiddelen (waar het document ook voor is opgesteld), geeft de ISO 31010 aan dat de HFMEA methodiek hiervoor aan alle gestelde eisen voldoet.
In essentie gaat het erom vooraf stil te staan bij veranderingen in processen. Welke risico’s kan de beoogde verandering met zich mee brengen? In de praktijk is er een groot verschil tussen het borgen van de veilige toepassing van onderstaande groepen:
- (voor afdeling/het ziekenhuis) nieuwe medische hulpmiddelen/technologieën,
- reeds bekende medische hulpmiddelen/technologieën in een nieuwe toepassing en
- reeds bekende medische hulpmiddelen/technologieën voor een bestaande toepassing.
Het uitgangspunt van de werkgroep is dat je beter eenvoudig kunt starten, bijvoorbeeld met het beschrijven van de risico’s die je nu al hebt gezien en waarom er in het verleden bepaalde keuzes zijn gemaakt. Hierbij is de stelling beter iets beschreven dan niets beschreven. Het verder uitbreiden/optimaliseren is veelal een leerproces.
Een ander aandachtspunt is het feit dat de aanschaf/vervangingswaarde van een hulpmiddel niet gecorreleerd is aan de risico’s van het hulpmiddel. Zo kan een relatief goedkoop hulpmiddel grote risico’s met zich mee brengen en hoeft dit bij een duur hulpmiddel niet altijd het geval te zijn. Binnen diverse centra is een investering en het proces van goedkeuren gekoppeld aan een bedrag van bijvoorbeeld 12k euro. Het uitvoeren van een risicoanalyse/bewandelen van het goedkeuringsproces bij vervanging van alleen deze apparatuur kan ongewenste risico’s met zich mee brengen. Er dient dus geborgd te worden dat risicomanagement uitgevoerd wordt voor alle hulpmiddelen, ongeacht de aanschafwaarde.
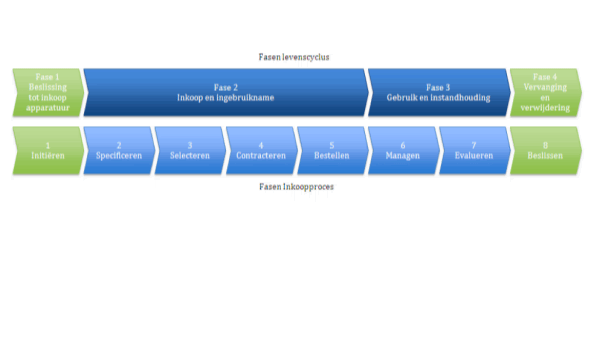
Om ervoor te zorgen dat (nieuw te bestellen) medische hulpmiddelen veilig toegepast zullen worden, speelt ook het inkoopproces een grote rol. Het inkoopproces zoals hier genoemd en bedoeld behelst de gehele levenscyclus van een hulpmiddel. In Figuur 2 zijn als voorbeeld de fasen uit de levenscyclus parallel aan het inkoopproces gelegd. Voor elke fase uit de levenscyclus wordt in het WINT document besproken welke stappen er met betrekking tot risicomanagement genomen dienen te worden.
Tips en tricks
In het WINT document zijn op hoofdlijnen de kaders en stappen voor de invoering van risicomanagement weergegeven, als ook de eisen om tot een succesvolle implementatie hiervan te komen. Hierbij zijn de volgende stappen door de werkgroep als cruciaal voor een succesvolle implementatie benoemd:
- Betrek het management
- Betrek alle relevante afdelingen/personen
- Borg het onderwerp in de organisatiestructuur
- Leg taken en verantwoordelijkheden vast
- Communiceer het beleid
- Borg het onderwerp in de PDCA-cyclus
Belangrijke punten die tijdens de pilot in februari 2015 naar voren kwamen:
- Zorg voor een vastgelegd mandaat
- Zorg dat er meerdere functionarissen met de verschillende risicoanalyse methodieken bekend zijn
- Documenteer wanneer je voor een bepaalde methodiek van risicoanalyse kiest, welke criteria je hierbij hanteert: De zogenaamde één uur PRI of de uitgebreide PRI
- Neem alle fasen gedurende de levensduur van een medisch hulpmiddel in de analyse mee.
Referenties
[1] Veilige toepassing van medische technologie in het ziekenhuis, 2011, Convenant NVZ, NFU en Revalidatie Nederland.
[2] https://www.koepelmt.nl/
[3] https://www.bmtz.nl/
[4] https://www.nvkf.nl/
[5] https://www.vzi.nl/
[6] https://www.wibaz.nl/