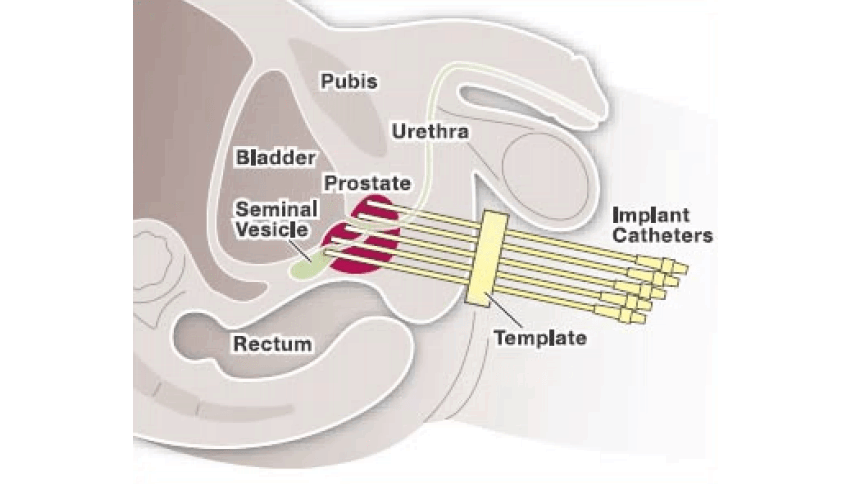
Prostaatkanker is de meest voorkomende vorm van kanker bij mannen. Brachytherapie, ofwel inwendige bestraling, is een effectieve manier om prostaatkanker te behandelen. Door radioactieve bronnen in de prostaat zelf te plaatsen, tijdelijk in catheters (figuur 1) of permanent in de vorm van zaadjes, worden de prostaatkankercellen door ioniserende straling op zeer lokale wijze onschadelijk gemaakt. Hierbij blijft het omliggende normale weefsel zo veel mogelijk gespaard.
Zo lokaal stralen als mogelijk
Bij gemiddeld en hoog risico prostaatkanker beperkt de tumor zich (mogelijk) niet langer tot alleen de prostaatklier. De prognose is dan een stuk slechter dan in de laag-risico groep met een risico van 20% om binnen 15 jaar te overlijden aan prostaatkanker [1]. De overleving zonder stijging in gemeten PSA na tien jaar varieert van 82%-92% voor gemiddeld-risico en van 62%-71% voor hoog-risico patiënten [2]. Uitwendige bestraling is dan de meest toegepaste behandeling.
De dosis kan ook rechtstreeks in de tumor worden afgegeven. Uitwendige bestraling gevolgd door een inwendig implantaat als boost kan een verbetering in de overleving betekenen of een besparing van toxiciteit opleveren [3]. Als de tumor tot de prostaat zelf beperkt is, de laag-risico groep, kan zelfs de gehele dosis van binnenuit worden gegeven. Dit wordt veel gedaan door permanente bestraling met een implantaat van radioactieve jodiumzaadjes.
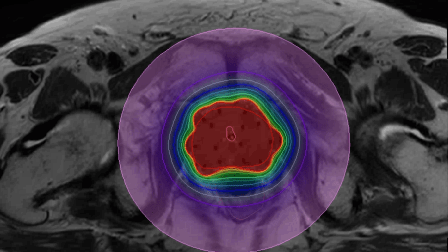
Een dergelijke lokale behandeling heeft als voordeel dat de dosis dan zoveel mogelijk beperkt blijft tot de prostaat zelf (figuur 2). Voor de omliggende stralengevoelige organen zoals de dunne darm en de blaas betekent een meer conformele dosis ook een verlaging van dosis op deze organen, hetgeen leidt tot een vermindering van klachten aan het darmstelsel en de urinewegen. Ook is het mogelijk de dosis op de prostaat zelf te verhogen, zonder dat de klachten toenemen [4]. Voor prostaatkanker is een duidelijke dosis-effect relatie aangetoond, waarbij het verhogen van de dosis resulteert in een verbeterde tumorcontrole [5].
PDR Prostaat brachytherapie
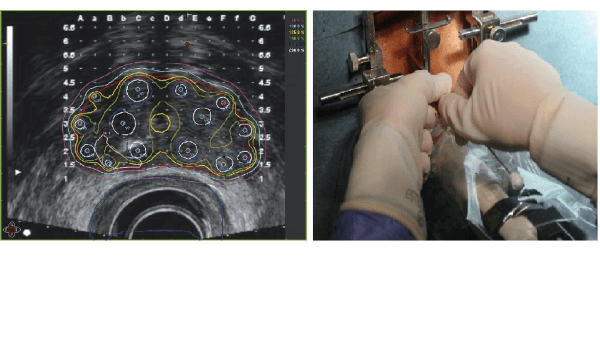
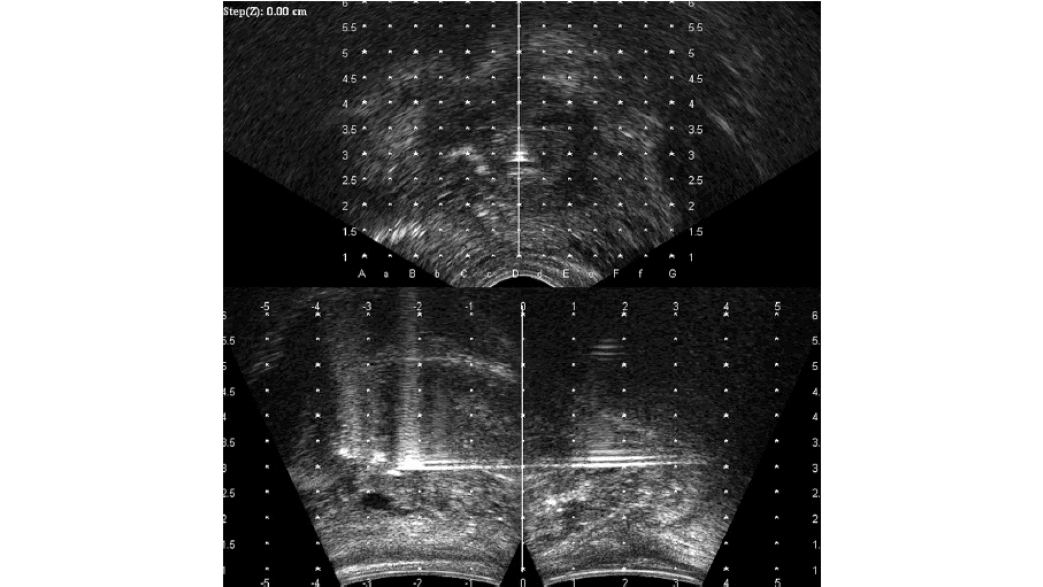
In het AMC is in 2002 gestart met pulsed-dose rate (PDR) brachytherapie van de prostaat, waarbij een deel van de dosis inwendig wordt gegeven, na de voorafgaande uitwendige radiotherapie. De dosis wordt in gelijke pulsen afgegeven, die elke 2 uur herhaald wordt. De behandeling bestaat uit bijvoorbeeld 24 pulsen die elk 10 à 20 minuten duren, afhankelijk van de sterkte van de bron. De implantatie van de prostaat met 12 tot 14 catheters wordt onder narcose uitgevoerd in de operatiekamer. Met een transrectale ultrasound probe wordt de prostaat in beeld gebracht en met een pre-plan wordt bepaald waar de catheters geplaatst moeten worden (figuur 3a). Vervolgens worden deze via een template transperineaal geïmplanteerd in de prostaat (figuur 3b).
Op de echo-beelden kan de prostaat zowel transversaal als sagittaal gevisualiseerd worden, om de catheters goed te verdelen over het volume en tegelijkertijd diep genoeg in de prostaat te brengen, zonder hierbij de blaas te perforeren (figuur 4). Nadat alle catheters geplaatst zijn kan de patiënt bijkomen en wordt er een scan gemaakt. Op deze scan (vaak plannings-CT of MRI genoemd) wordt de rest van de behandeling gebaseerd (figuur 5a). Op de scan zijn namelijk zowel organen als catheters zichtbaar en kunnen de brachylaboranten en arts samen bepalen welke catheter- en bronposities gebruikt worden voor de optimale verdeling van de dosis.
Waar te stralen? MRI versus CT
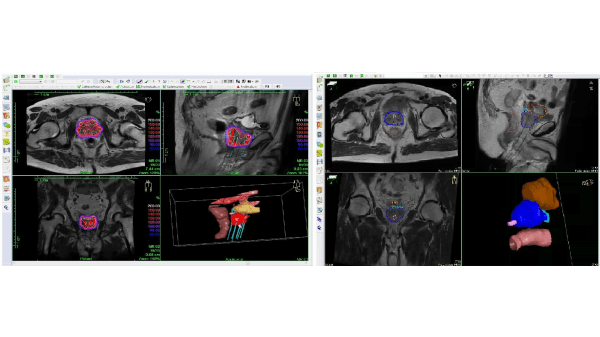
Het daadwerkelijke behandelplan wordt beschreven door een dosisverdeling, welke wordt bepaald door de locatie en de tijdsduur van de stappende bron in de tumor. De verblijftijden in de catheters worden bepaald door de optimalisatie van de dosisverdeling. Hierbij wordt rekening gehouden met de dosis in de tumor (deze moet voldoende hoog zijn en de voorgeschreven dosis moet de hele prostaat bedekken) en de dosis in de nabij gelegen organen en structuren waarvoor een bepaalde tolerantiedosis geldt.
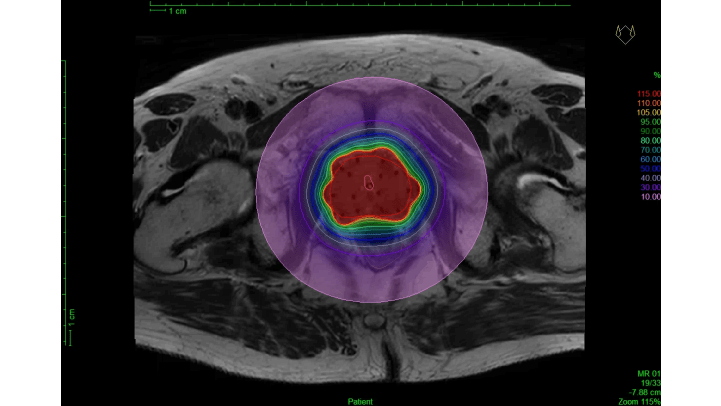
Het is van belang dat de tumor zelf, in dit geval de gehele prostaat, scherp in beeld wordt gebracht, zodat de arts het doelgebied nauwkeurig kan definiëren. Zijn bijvoorbeeld de overgang prostaat-blaas en de overgang darm-prostaat niet goed zichtbaar, dan kan er een te hoge dosis in deze kritieke organen (i.e. blaas en darm) terecht komen of juist te weinig dosis op de tumor. De prostaatcontouren gebaseerd op MRI beelden worden beschouwd als gouden standaard (figuur 5b). Gebruikt men de prostaatcontouren gebaseerd op CT voor de planning van de dosisverdeling, dan leidt dit over het algemeen tot een te lage dosis op de prostaat. Dit is vooral het geval in de buurt van de prostaat -blaas overgang. Ook kan de dosis op de darm op CT beelden onterecht als veilig worden beschouwd, terwijl deze feitelijk hoger is dan toegestaan [8].
Veranderingen tijdens de behandeling
Bij de PDR boost techniek op de prostaat wordt altijd de gehele prostaat als doelgebied beschouwd. Anders dan bij uitwendige bestraling hoeven er geen extra marges genomen te worden om te compenseren voor bewegingen van de prostaat in de buikholte. De geïmplanteerde catheters bewegen immers gewoon mee. Omdat de blaas en endeldarm onafhankelijk van de prostaat bewegen kan de dosisafgifte anders zijn dan berekend. De patiënt ligt 2 dagen in bed; in deze periode wordt elke 2 uur een puls gegeven. Wanneer er niet gestraald wordt kan de patiënt gewoon bezoek ontvangen, zonder dat iemand wordt blootgesteld aan ioniserende straling; De bron zit dan afgeschermd in de afterloader. De pulsen bestaan alle 24 uit hetzelfde stappende patroon van de bron door alle geïmplanteerde catheters. De verblijftijden op de verschillende posities zijn bepaald tijdens het planningsproces en gebaseerd op één enkele set CT of MRI slices. Deze scans geven de posities van de catheters en organen aan, enkele uren na implantatie. Tijdens de behandeling is het daarom van belang, dat deze situatie hetzelfde blijft; catheters mogen niet vervormen, verplaatsen, of uit de prostaat schuiven. De afstand tussen de prostaat en endeldarm is van belang, omdat vanwege de steile dosisgradiënt (de intensiteit van de bron neemt volgens de kwadratenwet af bij toenemende afstand) een kleine verandering in afstand al een grote verandering in de geabsorbeerde dosis in de darmen kan betekenen [9].
Verminderen van bijwerkingen
Deze radiotherapeutische behandeling van het prostaatcarcinoom met twee modaliteiten, uitwendige bundels gevolgd door brachytherapie, heeft als doel de lokale controle te verbeteren en de bijwerkingen van de behandeling te verminderen. Met dosisescalatie is gebleken dat de tumorcontrole beter is. Momenteel worden er studies gedaan om te onderzoeken of verdere dosisescalatie mogelijk is zonder toename van bijwerkingen. Met de hoge incidentie van prostaatkanker terwijl de kankervrije overlevingsduur toeneemt, is het van belang dat men vele jaren na behandeling niet alleen kankervrij, maar ook klachtenvrij kan leven.
ADDENDUM: Prostaatkanker, meest voorkomende kanker bij mannen
Sinds de beschikbaarheid van PSA (prostaat-specific antigen) als biomarker voor de detectie van prostaatkanker, is de incidentie van prostaatkanker in de afgelopen 20 jaar fors toegenomen. Deze stijging bedroeg 3-4% per jaar vanaf 1990. Momenteel lijkt een plateau bereikt [10]. Prostaatkanker is de meest voorkomende kanker bij mannen in Europa, met naar schatting 382.000 nieuwe gevallen in 2008. In datzelfde jaar overleden zo’n 89.000 mannen aan deze ziekte, waarmee prostaatkanker op de derde plaats staat van meest voorkomende doodsoorzaak bij mannen, na long- en darmkanker [11]. In Nederland bedroeg de incidentie in 2011 waren er 11.421 nieuwe gevallen, met 2.500 sterfgevallen in dat jaar [12].
Laag risico prostaatkanker: overdetectie en overbehandeling
Bij vroegtijdige detectie worden radicale prostatectomie en inwendige bestraling door implantatie van radioactieve jodiumzaadjes (I-125) veel toegepast. De tumoren bevinden zich dan binnen het prostaatkapsel. In deze laag-risico groep is de prostaatkankersterfte 15 jaar na detectie slechts 5%. Laag-risico prostaatkanker is onderhevig aan veel discussie; De vroegtijdige detectie van een verhoogde PSA waarde zou kunnen leiden tot overdiagnose en overbehandeling. Prostaattumoren komen vooral onder ouderen veel voor, en worden vaak gekenmerkt door een langzame groei. Sterker nog, in 30-40% van de zestigjarige mannen kan prostaatkanker worden aangetoond, zonder enige klachten of klinische aanwijzing [13]. Pas als de prostaattumor sneller gaat groeien met een PSA verdubbelingstijd van 3 jaar of korter, zou klinisch moeten worden ingegrepen. De daadwerkelijke symptomen en klachten dienen zich gemiddeld pas op 72 jarige leeftijd aan. Naast het onderzoek dat wordt gedaan naar de effectiviteit van screening (winst in overleving), is ook het onderzoek naar overbehandeling een hot-topic. Hoe effectief de behandeling is van patiënten met een laag risico ten opzichte van afwachten is tot nog toe onbekend. Daarom is in 2006 in het Erasmus MC een trial gestart met “active surveillance”: “Prostate cancer Research International: Active Surveillance (PRIAS)” [14]. Pas op het moment dat wordt geconstateerd dat ‘laag-risico’ overgaat in ‘gemiddeld-risico’ wordt alsnog overgegaan op een actievere vorm van behandeling. Zowel kosteneffectiviteit als verschil in de overleving van prostaatkanker worden in PRIAS onderzocht. Verder zijn psychische gesteldheid van mannen waarbij een stijgende PSA gedetecteerd is en de bijwerkingen van actieve behandeling belangrijke onderwerpen voor onderzoek.
ADDENDUM: uitwendige bestraling
Bij patiënten met een gemiddeld tot hoog risico beperkt de tumor zich mogelijk niet alleen tot de prostaatklier. Dan wordt veelal uitwendige bestraling toegepast, met een dosis op de prostaat variërend van 70 tot 80 gray, meestal verdeeld over zo’n 35 dagelijkse sessies. Bij uitwendige radiotherapie wordt met een lineaire versneller een electronenbundel (4-25 MeV) op een metalen target van hoge dichtheid (wolfraam) gestuurd, waardoor fotonenstraling ontstaat met een spectrum van energieën tot aan die van de electronenbundel. De kop van de machine bestaat uit een collimator (diafragma) die een opening vormt corresponderend met het doelgebied.
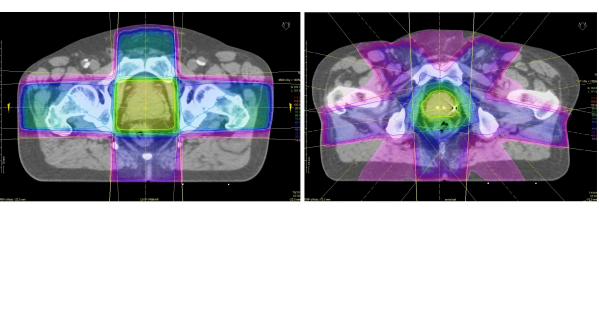
Met Intensity Modulated Radiation Therapy (IMRT) kan binnen iedere bundel de intensiteit worden gevarieerd zodat de vorm van het hoge dosisgebied zo goed mogelijk overeenkomt met het te bestralen doelgebied. Over het algemeen wordt de prostaat bestraald met 5 bundels uit verschillende invalsrichtingen, dat wil zeggen dat er uit 5 verschillende richtingen een speciaal voor het doelgebied ontworpen fotonenbundel wordt afgegeven. Waar bij het gebruik van 4 bundels (conventionele ‘box-techniek’) de dosis buiten het doelgebied nog zo’n 50 tot 60% van de totale voorgeschreven dosis bedraagt, is dat bij 5 bundel IMRT al gedaald tot 10 – 40% van de voorgeschreven dosis (figuur 6). Het verbeteren van bestralingstechnieken (arc-therapie, tomo-therapie, stereotactische bestraling, etc) en met real-time imaging van de locatie van het doelgebied zorgen voor een voortdurende verbetering in de dosisafgifte.
Een probleem bij uitwendige bestraling is dat de prostaat kan bewegen, bijvoorbeeld door veranderingen in blaas- en darmvulling. Om te compenseren voor deze beweging, en er dus voor te zorgen dat de tumor altijd voldoende bestraald wordt, maakt men gebruik van marges. Tegenwoordig wordt steeds meer gebruik gemaakt van geïmplanteerde markers, waarmee de locatie van de prostaat kan worden bepaald voorafgaand of zelfs gedurende de bestraling. Dankzij de voortdurende technologische ontwikkeling verbetert de conformiteit van deze behandeling en kunnen de marges steeds kleiner worden.
ADDENDUM: een stap terug in de tijd – brachytherapie door de jaren heen
Al vrij snel na de ontdekking van Radium (Ra226) door Marie en Pierre Curie (1898, Parijs) werd de eerste succesvolle brachytherapie behandeling uitgevoerd in Sint Petersburg bij huidkanker (figuur 7).
De eerste beschrijving van de behandeling van een prostaatcarcinoom stamt uit 1910 [15], waarin beschreven wordt hoe een 32 jarige man met een vuistgrote tumor behandeld werd met radioactief materiaal en maar liefst 20 applicaties van 20 minuten onderging. Hierbij werd een buisje gevuld met 4.7 mg radiumbromide door een fistel in de buikwand in de blaas gebracht en tegen de tumor geplaatst. De inoperabele tumor was na behandeling verdwenen en de patiënt, die een zeer slechte prognose had, was na een paar weken terug in ‘excellente’ conditie.
In de natuur voorkomende radio-isotopen zoals radium zijn niet geschikt voor implantatie in de prostaat. Nieuwe vormen van behandeling zoals het verwijderen van de gehele prostaat (radicale prostatectomie) en hormoontherapie verdrongen de brachytherapy. Wel kwamen er vanaf de jaren dertig van de vorige eeuw door de ontwikkeling van het cyclotron en de nucleaire reactor steeds meer (radio-)isotopen beschikbaar.
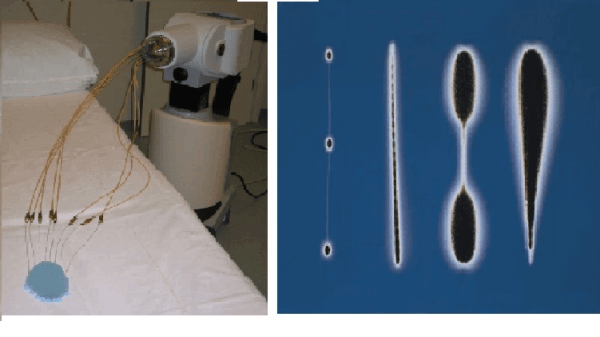
Tot 1950 werden radioactieve bronnen handmatig geprepareerd en geplaatst, waarbij de behandelaars in hoge mate werden blootgesteld aan ioniserende straling. Men kwam daarom al in het begin van de 20e eeuw op het idee van ‘afterloading’. Met (manuele) afterloading worden catheters of applicatoren geplaatst voordat de radioactieve bron wordt ingebracht. Naast een verlaging van de dosis op het personeel, leidt dit ook tot een meer nauwkeurige dosisafgifte. In de jaren 60 kwam de eerste remote-afterloader op de markt. Deze heeft in de loop der jaren een grote technische ontwikkeling doorgemaakt, met name op het gebied van de manier waarop een of meerdere bronnen tegelijk vanuit de afterloader in de vooraf ingebrachte applicator, naalden of catheters (het implantaat) worden gebracht. Tegenwoordig wordt gebruikt gemaakt van een enkele, vaak zeer hoog-actieve bron van kleine afmeting (1-5 mm) welke bevestigd is aan een dunne staaldraad. De bron verblijft computergestuurd op voorgeprogrammeerde posities in de geïmplanteerde catheters, de zogenaamde “stepping source” techniek (figuur 8a en b).
Met de beschikking over afterloaders en kunstmatige isotopen zoals Cesium-137, Cobalt-60 en Iridium-192 beleefde de brachytherapie een revival. De bronnen gemaakt van deze isotopen zijn klein (hoge specifieke activiteit) en hebben een relatief lange halfwaardetijd en hoeven dus maar eens in de aantal maanden te worden vervangen. De laag energetische gamma- en röntgenstraling afkomstig van deze materialen heeft een geringe doordringdiepte (voor lokale afgifte) en is eenvoudig te verzwakken met enkele millimeters lood.
Referenties
[1] TJ Wilt etl al TJ, Prostate cancer screening and the management of clinically localized disease. BMJ 2013;346:f325.
[2] TM Pisansky et al, High-dose-rate brachytherapy in the curative treatment of patients with localized prostate cancer. Mayo Clin Proc 2008;83:1364-1372.
[3] PJ Hoskin et al, High dose rate brachytherapy in combination with external beam radiotherapy in the radical treatment of prostate cancer: initial results of a randomised phase three trial. Radiother Oncol 2007;84:114-120.
[4] MJ Zelefsky et al, Clinical experience with intensity modulated radiation therapy (IMRT) in prostate cancer. Radiother Oncol 2000;55:241-249.
[5] A Pollack et al. Prostate cancer radiation dose response: results of the M. D. Anderson phase III randomized trial. Int J Radiat Oncol Biol Phys 2002;53:1097-1105
[6] B Pieters et al, Contrast-enhanced ultrasound as support for prostate brachytherapy treatment planning. J Contemp Brachytherapy 2012;4:69-74
[7] E Kaljouw et al, Benefits of a dual sagittal crystal transducer for ultrasound imaging during I-125 seed implantation for permanent prostate brachytherapy. J Contemp Brachytherapy 2012;4:141-145
[8] AM Dinkla et al, Improved tumour control probability with MRI-based prostate brachytherapy treatment planning. Acta Oncol 2013
[9] AM Dinkla et al, Deviations from the planned dose during 48hours of stepping source prostate brachytherapy caused by anatomical variations. Radiother Oncol 2013
[10] F Bray et al, Prostate cancer incidence and mortality trends in 37 European countries: an overview. Eur J Cancer 2010;46:3040-3052
[11] J Ferlay et al, Estimates of cancer incidence and mortality in Europe in 2008. European Journal of Cancer 2010;46:765-781
[12] Nederlandse Kankerregistratie. http://cijfersoverkanker.nl/. 2013
[13] S Frankel et al, Screening for prostate cancer. Lancet 2003;361:1122-1128
[14] CH Bangma et al, Active surveillance for low-risk prostate cancer. Crit Rev Oncol Hematol 2012
[15] R Paschkis et al, Radium behandlung eines Prostatasarkoms. Wiener Klinische Wochenschrift 1910;48:1715-1716
[16] RF Mould et al, Brachytherapy from Radium to Optimization. Veenendaal: Nucletron International B.V., 1994