De incidentie van zowel primaire als secundaire levertumoren is de afgelopen decennia wereldwijd toegenomen. Primaire levertumoren, zoals hepatocellulair carcinoom, en secundaire tumoren, voornamelijk colorectale levermetastasen, zijn steeds vaker voorkomende diagnoses. Dit door de vergrijzing van de bevolking en de stijgende prevalentie van risicofactoren zoals obesitas, diabetes en chronische leverziekten. [1] De toename in incidentie vraagt om de ontwikkeling van effectievere behandelingsstrategieën.
Leverablatie is een minimaal invasieve behandeling voor zowel primaire als secundaire levertumoren. Via beeldgeleiding, zoals echografie of CT-scans, wordt de tumor in beeld gebracht. Vervolgens worden er een of meerdere naalden in de tumor geplaatst. Deze naalden zitten aangesloten aan een generator die radiofrequente of microgolven genereert. Dit resulteert in lokale verhitting rondom de tip van de naald (afbeelding 1). De verhitting zorgt ervoor dat het tumorweefsel verbrandt en necrotisch wordt. Deze interventie oncologische behandeling heeft voordelen zoals een korte hersteltijd en een relatief laag risico op complicaties, waardoor patiënten vaak na een korte ziekenhuisopname naar huis kunnen. Door voortdurende technologische ontwikkelingen heeft deze behandeling zich de afgelopen decennia verder ontwikkeld tot een belangrijke behandeloptie voor levertumoren.
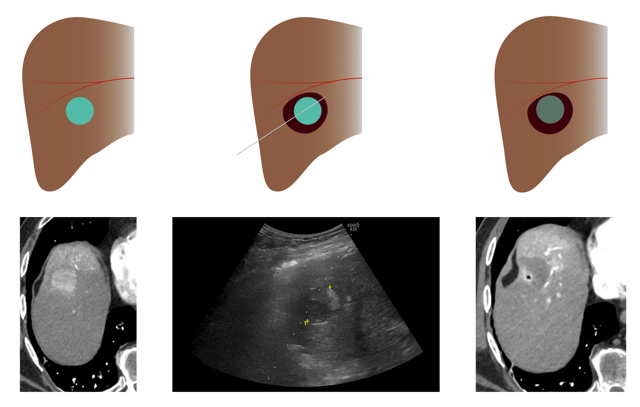
Links: Vooraf aan de ablatieprocedure wordt de tumor op een CT-scan in beeld gebracht.
Midden: Onder naaldgeleiding, in dit geval ultrasound, wordt de naald in de tumor gebracht. Door radiofrequente of microgolven wordt het weefsel verhit, waardoor een necrotische holte ontstaat
Rechts: Na de ablatie wordt wederom een CT-scan gemaakt waarop de necrotische holte te zien is.
Historisch gezien was leverresectie de eerste behandeloptie voor resectabele primaire en secundaire levertumoren, vanwege het lagere lokaal recidiefpercentage in vergelijking met ablatie. Wanneer patiënten niet in aanmerking kwamen voor een lever resectie, door bijvoorbeeld onderliggende leverziekte of een ongunstige tumorlocatie, bood leverablatie een goed alternatief. De laatste jaren is echter veel onderzoek gedaan naar hoe we de effectiviteit van leverablatie kunnen verbeteren, waarbij technologische innovaties een belangrijke rol hebben gespeeld en dit nog steeds doen. Dankzij deze ontwikkelingen is het lokaal recidiefpercentage na behandeling gedaald. Hierdoor is ablatie nu de behandeling van eerste keuze voor primaire levertumoren kleiner dan 2 cm. Bovendien heeft recent onderzoek aangetoond dat leverablatie voor colorectale levermetastasen onder de 3 cm minder complicaties, een kortere opnameduur en betere lokale tumorcontrole biedt in vergelijking met leverresectie. [2]
Van visuele inschatting naar geavanceerde 3D-modellen
Het doel van leverablatie is om de tumor volledig weg te branden inclusief een veiligheidsmarge rondom de tumor, om de kans op lokale tumorprogessie te verminderen. Het kwantificeren van deze marge is een uitdaging. Door het maken van een CT-scan zowel vóór als na de behandeling kunnen we respectievelijk de tumor en ablatieholte in beeld brengen. Op basis van vergelijking van deze beelden kan de interventieradioloog de marge visueel inschatten (eye-balling). Deze methode is echter subjectief en gevoelig voor foutieve inschattingen. Daarom wordt er nu toegewerkt naar kwantitatieve bepaling van de marge door het gebruik van registratie software. In de vervaardigde CT-scans wordt de tumor dan wel de ablatieholte gesegmenteerd. Door beeldregistratie wordt vervolgens een 3D-model gecreëerd waarin de tumor in de ablatieholte wordt geprojecteerd (afbeelding 2). De software berekent de behaalde minimale ablatiemarge en visualiseert waar de marge het krapst is. In het geval van achtergebleven tumorweefsel of een te krappe marge kan er een aanvullende ablatie plaatsvinden, wat de uitkomsten van de behandeling zal verbeteren. [3, 4]
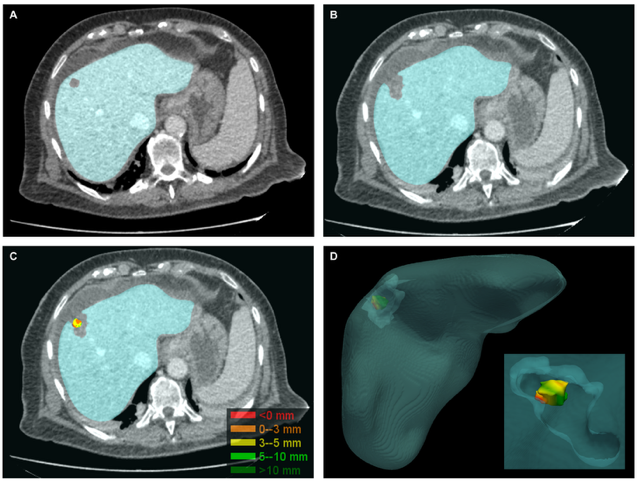
A: op de CT-scan gemaakt voor ablatie wordt de tumor gesegmenteerd
B: op de CT-scan gemaakt voor ablatie wordt de ablatieholte gesegmenteerd
C: Door rigide beeldregistratie wordt de tumor in de ablatieholte geprojecteerd. De minimale ablatiemarge wordt berekend.
D: Een 3D-model wordt gegenereerd waarin de locatie van de minimale ablatiemarge zichtbaar is.
Er wordt gestreefd naar een minimale ablatiemarge van 5 mm voor primaire tumoren. Voor secundaire levertumoren varieert de mening voor een optimale marge van 5 tot 10 mm. Deze normen zijn gebaseerd op expert opinies, maar er is nog geen consensus over wat de optimale marge voor ablatie is.
Om dit te achterhalen voor de primaire levertumoren is vanuit het LUMC een prospectieve multicenter studie uitgevoerd, met medewerking van alle UMC’s in Nederland. [5] In deze studie zijn de gegevens en ablatieprocedure beeldvorming van 200 patiënten verzameld. De behaalde ablatiemarges zullen retrospectief worden bepaald met een in-huis ontwikkelde software (afbeelding 2). Door de patiënten drie jaar na de ablatie te volgen, kunnen lokaal recidieven geïdentificeerd worden. Zo zal bepaald worden welke marge zal leiden tot een lokaal recidiefpercentage lager dan 10%. Deze kennis zal belangrijk zijn om registratie software klinisch in te zetten.
Er is tegenwoordig verschillende CE-gemarkeerde software voor ablatie marge kwantificatie op de markt. Ook is er software die uitsluitend voor onderzoek gebruikt wordt, enerzijds om kennis te vergaren en anderzijds om verdere ontwikkeling van de software te ondersteunen. Al deze software verschilt onderling van elkaar op verschillende punten. Sommige software maakt gebruik van rigide beeldregistratie, waarbij enkel verplaatsing en rotatie van de beelden plaatsvindt. Andere software maakt gebruik van non-rigide beeldregistratie, waarbij de beelden kunnen worden vervormd om een optimale overeenkomst te bereiken. Vanwege deze verschillen is er veel onderzoek gericht op het vergelijken van de prestaties van verschillende software en het effect hiervan op de bepaling van de minimale ablatiemarge, aangezien de keuze van de techniek invloed kan hebben op de nauwkeurigheid en betrouwbaarheid van de margemetingen. [6]
Toekomst en ontwikkelingen
Er vindt continue verbetering van de software plaats. De huidige ontwikkelingen richten zich op het inzetten van artificial intelligence voor de automatische segmentatie van de lever, tumor en ablatieholte. Door deze stappen in het proces te automatiseren, proberen we de variabiliteit tussen observers te minimaliseren, wat resulteert in meer consistente en betrouwbare metingen. Daarnaast zal door automatisering het proces minder tijdrovend worden, wat de klinische toepasbaarheid vergroot. De kwantificatie van de ablatiemarge middels 3D modellen maakt het ook mogelijk om meer geavanceerde parameters te onderzoeken, zoals het oppervlaktepercentage van de tumor wat onvoldoende marge (<5 mm) heeft behaald. Het combineren van meerdere paramaters kan helpen bij het nauwkeuriger voorspellen van het risico op lokaal recidief na behandeling.
Naast de het inzetten van software voor marge kwantificatie zijn er meer technische ontwikkelingen welke als doel hebben de effectiviteit van leverablaties te verbeteren. [7] Verschillende software richt zich op de planning van de ablatie. De naaldpositie wordt hierin gepland op de CT-scan gemaakt voor ablatie, om zo de instellingen van de apparatuur te bepalen. Vervolgens kunnen door inzet van navigatie of robottechnieken de geplande naaldposities nagestreefd worden.
De voortdurende technologische ontwikkelingen in leverablatie, zoals de inzet van software voor marge kwantificatie, spelen een cruciale rol in het verbeteren van de behandelresultaten. Deze innovaties dragen bij aan een efficiëntere behandeling, met een kortere ziekenhuisopnames ten opzichte van resectie, wat essentieel is gezien de stijgende incidentie van levertumoren en de toenemende druk op de gezondheidszorg.