Positron emissie tomografie (PET) is een medische beeldvormende techniek waarmee het mogelijk is om verschillende farmacokinetische parameters van weefsels in vivo te kwantificeren (1). Dit wordt mogelijk gemaakt door de hoge sensitiviteit van de PET detectoren waardoor er maar een kleine hoeveelheid van een radioactief gemerkte stof (tracer hoeveelheid, typisch zo’n 4 nanomol voor een whole-body [18-F]FDG scan) hoeft te worden geïnjecteerd. Dergelijke kleine hoeveelheden kunnen de fysiologische of moleculaire interacties in een patiënt niet beïnvloeden, zodat (patho)fysiologische processen accuraat in vivo gemeten kunnen worden.
Kwantitatieve beeldvorming
De beeldvorming en kwantitatieve mogelijkheden van PET worden in kliniek en research gebruikt om weefselfuncties zoals perfusie, metabolisme, enzym activiteit, receptordichtheid, ‘neurotransmitter release’, en ‘drug tumor targeting’ te onderzoeken. In de kliniek is vooral [18-F]FDG PET bekend maar in research worden er meerdere radiotracers gebruikt, vaak met een klinische toepassing als doel. Belangrijkste toepassingen van PET zijn daarom te vinden in de oncologie (2), waarbij er naast diagnose (stadiëring) ook kwantitatieve veranderingen in weefselfuncties en daarmee bijvoorbeeld de effectiviteit van nieuwe medicijnen kunnen worden onderzocht (3). Daarnaast wordt PET veel gebruikt bij onderzoek naar neurodegeneratieve ziekten, zoals de ziekte van Alzheimer en Parkinson (4-8).
PET beelden zijn vooral functioneel, anatomische imaging wordt gedaan met ‘magnetic resonance imaging’ (MRI) of computer tomografie (CT). Verder hoeft informatie over verdeling en amplitude van functionele processen niet samen te gaan met anatomisch informatie. Combineren van imaging modaliteiten is dus een logische stap.
PET-CT
In 2008 publiceerde David Townsend een artikel (9) waarin hij terugkeek op de ontwikkeling die, volgens TIME magazine, in 2000 leidde tot ‘the Medical Science Invention of the year’ (10). In het artikel is te lezen dat de eerste commerciële PET-CT scanner in 2001 op de markt kwam, en er in 2006 al geen stand-alone PET scanners meer te koop waren. Hoewel niet helemaal accuraat geldt dit in ieder geval voor mainstraem whole body PET imaging. Een overzicht van huidig verkrijgbare PET-CT systemen is te vinden onder (11).
Als we inzoomen op ons land dan is de situatie als volgt. In 2000 stonden er nog slechts 3 PET cameras in Nederlandse ziekenhuizen. In het najaar van 2003 werd, slechts twee jaar na de wereldwijde introductie, in Nederland het eerste PET-CT systeem geïnstalleerd in Maastricht. In 2005 waren er al 16 PET(-CT) systemen operationeel in Nederland.Inmiddels wordt in de meest recente enquête onder ziekenhuizen (12) 44 PET- of PET-CT systemen gerapporteerd.
Er zijn verschillende redenen voor het combineren van een PET camera met een andere modaliteit:
- Een op CT gebaseerd anatomisch beeld biedt een referentiekader ter interpretatie van de PET beelden
- CT informatie kan gebruikt worden voor accurate scatter en attenuatie correctie
- Patiënten logistiek kan verbeteren door een ‘one-stop-shop’ benadering
De technische integratie van PET en CT was relatief eenvoudig, omdat de CT component in tact kon blijven (volledige functionaliteit) en er aan PET kant geen wijzigingen nodig waren in de wijze waarop 511 keV fotonen gedetecteerd worden (scintillator + photomultiplier buis). Dit leidde tot de volgende resultaten:
1) De patiënt wordt niet simultaan, maar sequentieel gescand. Tussen de PET en CT scan wordt de tafel van de ene naar de andere gantry bewogen. De CT scan duurt een paar seconden en wordt in een normale ademhalingstoestand gemaakt, zodat er altijd kans is op bewegings c.q. ademhalings geinduceerde mismatch tussen de PET en de CT scan. Voor een goede beoordeling van scans zal men derhalve zowel het attenuatie gecorrigeerde als ook het niet-attenuatie gecorrigeerde (NAC) beeld moeten bekijken (voor details zie (13)).
2) Attenuatiecorrectie is gebaseerd op de conversie van CT gebaseerde Hounsfield Units (HU) naar attenuatie coefficient waarden voor 511 keV photonen (14). Scattercorrectie is gebaseerd op een NAC beeld, een CT gebaseerd masker voor wel / geen verzwakkend medium in het FOV en een monte carlo scatter simulatie. De rol van het CT gebaseerde masker neemt af in de nieuwe generatie scatter correctie methoden, waarbij de schalingsfactor van de scatter correctie ook uit de simulatie gehaald wordt (15).
Het resultaat van de introductie van PET-CT in de kliniek is zeer positief te noemen. Als voorbeeld zou de inclusie van FDG kwantitatieve opnamemetingen in respons criteria te noemen zijn (16).
De combinatie van PET en CT heeft ook nadelen: niet simultaan, extra stralingsdosis door de CT scan en laag soft tissue contrast. Sinds een aantal jaren probeert men na te gaan of de combinatie van PET en MRI de voordelen van PET-CT kan behouden, maar dan zonder deze nadelen.
PET-MRI
Een recente ontwikkeling is daarom de combinatie van PET en MRI. Anno 2015 is een viertal commerciële PET/MRI systemen beschikbaar voor whole body imaging (17, 18, 19, 20). MRI imaging wordt veel toegepast in de klinische praktijk vanwege het hoge contrast dat gecreëerd kan worden tussen de verschillende type weefsels. Contrastverschillen worden bereikt door acquisitie van verschillende relaxatie parameters zoals T1, T2 etc. Verder kan er ook functionele informatie zoals MR spectroscopy (MRS) worden verkregen met behulp van MRI.
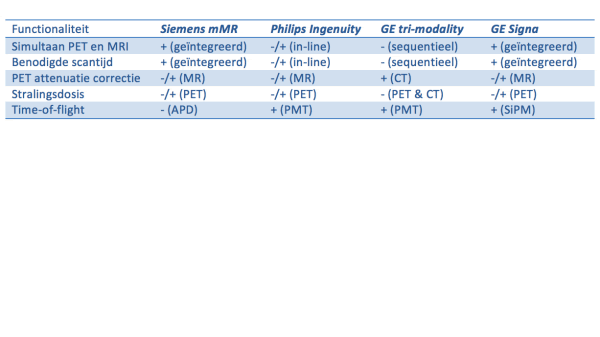
De integratie van de PET met een MRI was niet eenvoudig want er moest een aantal technische uitdagingen worden overwonnen. Zie Tabel I voor een vergelijking van de functionaliteiten die handig zijn bij PET studies. De MRI heeft een gecontroleerd en uniform magnetische veld en radiogolven (RF) nodig. Elektronische apparatuur dicht in de buurt van een MRI kan de MR beeldkwaliteit verslechteren, dus dienen alle elektronische systemen hiervoor te worden afgeschermd. Anderzijds moet (PET) elektronica worden beschermd tegen het sterke magnetische veld en de RF golven. Daarbij zijn vooral de Photon Multiplier Tubes (PMT) gevoelig voor sterke magnetische velden. Bij een aantal PET/MRI modellen is gekozen om de PET gantry op enige afstand van de MRI te plaatsen (GE tri-modality, Philips Ingenuity PET/MR) of op zoek te gaan naar nieuwe op halfgeleider gebaseerde detector techniek waarvan de performance bestand is tegen sterke magneetvelden (Siemens Biograph mMR, GE Signa PET/MR).
Beperkingen
Een belangrijke beperking voor kwantitatieve PET bij PET/MRI systemen is de kwaliteit van de correctie voor foton attenuatie. Omdat er geen CT of transmissie bronnen gebruikt worden kan er geen absolute meting gedaan worden voor de foton attenuatie. Een CT kan niet naast een MRI gantry worden gezet omdat op bewegende metalen objecten in een magneetveld diverse krachten werken. De beschikbare commerciële PET/MRI systemen, met uitzondering van de Ge tri-modality, maken alleen gebruik van een op MRI gebaseerde schatting van de foton attenuatie. Attenuatie correctie van PET op basis van CT is superior aan correctie op basis van segmentatie van een MR image (zie figuur 1): MR-truncatie bij de armen; alleen lucht buiten lichaam, weefsel en long segment maar geen segment voor o.a. botten, vet en lucht in patient; patient tafel en MR-coils zijn niet te meten mbv MRI deze moeten achteraf bij geplaatst worden; software technisch is segmentatie proces niet robuust bv long segmentatie mislukt in ~10% van de gevallen. Deze schatting van de foton attenuatie is nog niet optimaal en er is nog volop onderzoek naar verbeterde op MR gebaseerde attenuatie uit regio’s met zeer laag MRI signaal zoals botten, longen en MR-coils.
Conclusie
Op dit moment zijn er eigenlijk geen klinische standalone PET systemen meer in gebruik. Het overgrote deel van de PET systemen wordt gebruikt in een combinatie met een CT systeem. Voordelen hiervan zijn het beschikbaar hebben van een anatomisch referentiebeeld voor de PET beelden alsmede de mogelijkheid om accuraat voor scatter en attenuatie te corrigeren. Als mijlpaal voor klinische acceptatie van deze techniek kan de introductie van de PERCIST criteria gelden (response evaluatie op basis van FDG PET scans). Op dit moment wordt gepoogd (vooral voor pediatrische toepassingen en voor toepassingen waarbij goed tissue contrast nodig is) om het klinisch belang van PET-MRI systemen na te gaan. Deze ontwikkeling is nog volop in beweging.
Referenties
[1] MM Ter Pogossian et al, A postron-emission transaxial tomograph for nuclear imaging (PET), Radiology 114:89-98, 1975
[2] P Lewis et al, Whole-body F-18 Fluorodeoxyglucose Positron Emission Tomography in Preoperative Evaluation of Lung-Cancer, Lancet 344:1265-1266, 1994
[3] WA Weber. Assessing tumor response to therapy. J Nucl Med 50 Suppl 1:1S-10S, 2009
[4] A Schuitemaker et al. Microglial activation in healthy aging. Neurobiol Aging 33:1067-77, 2012
[5] N Tolboom et al. Detection of Alzheimer Pathology In Vivo Using Both 11C-PIB and 18F-FDDNP PET. J Nucl Med 50:191-7, 2009
[6] BN Van Berckel et al. Microglia activation in recent-onset schizophrenia: a quantitative (R)-[11C]PK11195 positron emission tomography study. Biol Psychiatry 64:820-2, 2008
[7] BN Van Berckel et al. Longitudinal Amyloid Imaging Using 11C-PiB: Methodologic Considerations. J Nucl Med 54:1570-6, 2013
[8] M Yaqub et al. Quantification of dopamine transporter binding using [18F]FP-beta-CIT and positron emission tomography. J Cereb Blood Flow Metab 27:1397-1406, 2007
[9] D.W. Townsend, Combined PET/CT: the historical perspective, Semin Ultrasound CT MR. 29(4), 2008
[10] Time Magazine, Inventions of the year, december 4, vol 156 (23), 2000
[11] R.Rocha, Comparison chart PET/CT systems, itnonline.com, May 2014
[12] I.R. de Waard, RIVM Rapport 300080008/2011 Inventarisatie van ontwikkelingen van PET-CT, 2011
[13] R. Boellaard et al., FDG PET/CT: EANM procedure guidelines for tumour imaging: version 2.0, dec. 2014.
[14] S.R. Cherry et al., Physics in nuclear medicine, chapter 19, 4th edition, 2012.
[15] J. Ye et al., Scatter correction with combined Single-Scatter Simulation and Monte Carlo Simulation for 3D PET, IEEE NSS MIC conference proceedings M32-6, 1014.
[16] E.A. Eisenhauer et al, New response evaluation criteria in solid tumors: revised RECIST guideline (version 1.1), Eur. J. Cancer 45:228-247, 2009.
[17] G Delso et al. Performance measurements of the Siemens mMR integrated whole-body PET/MR scanner. J Nucl Med 52(12):1914-1922:2011.
[18] H Zaidi et al. Design and performance evaluation of a whole-body Ingenuity TF PET-MRI system. Phys Med Biol 56(10):3091-3106:2011.
[19] V Bettinardi et al, Physical performance of the new hybrid PETCT Discovery-690. Med Phys 38(10):5394-5411:2011.
[20] KG Zeimpekis et al, Clinical Evaluation of PET Image Quality as a Function of Acquisition Time in a New TOF-PET/MRI Compared to TOF-PET/CT-Initial Results. Mol Imaging Biol. (DOI: 0.1007/s11307-015-0845-5) 2015
[21] E Roncali et al, Application of silicon photomultipliers to positron emission tomography, Ann Biomed Eng 39(4), 2011