De wereldwijde prevalentie van chronisch nierfalen stijgt door vergrijzing van de bevolking en een toename van de prevalentie van diabetes mellitus en obesitas. Dankzij deze toename en de enorme ziektelast die hiermee gepaard gaat, is voorspeld dat in 2040 chronisch nierfalen bij de vijf meest voorkomende oorzaken van verloren levensjaren zal behoren [1, 2]. Het aantal patiënten dat behandeld moet worden met nierfunctie-vervangende therapieën zal de druk op de gezondheidszorg nog meer doen toenemen, waarbij met name de behandeling met hemodialyse economische uitdagingen met zich meebrengt.
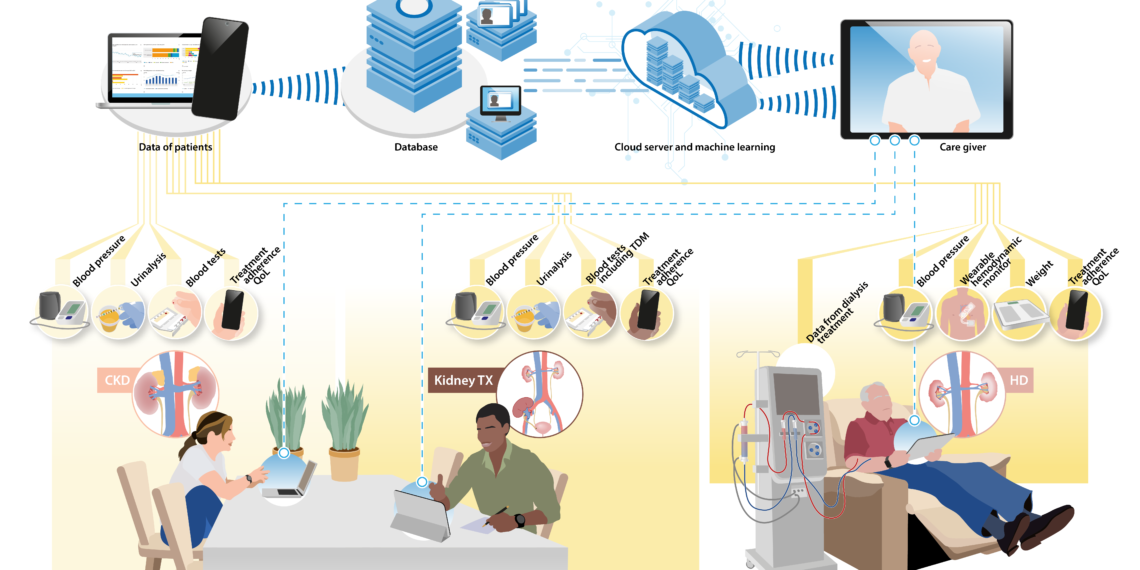
Daarnaast heeft deze behandeling, die levensreddend is voor patiënten met eindstadium nierfalen, een enorme impact op het milieu. Dit komt onder andere door de grote hoeveelheid water die hiervoor nodig is [3]. Patiënten met nierfalen zijn vaak kwetsbaar. Niet alleen door het nierfalen zelf maar ook door bijkomende aandoeningen zoals hart- en vaatziekten. Daarom zijn deze patiënten een belangrijke doelgroep voor thuismonitoring. Momenteel worden ook al enkele eenvoudige technieken, zoals bloeddrukmetingen, op grote schaal in de thuissetting toegepast. Als de urineproductie afneemt, stijgt de bloeddruk doordat het lichaam meer vocht vasthoudt. Daarom meten patiënten regelmatig thuis hun bloeddruk en gewicht. Voor analyse van urine en bloed moeten patiënten echter nog vaak op afspraak komen bij de huisarts of in het ziekenhuis, maar dankzij technische ontwikkelingen en verbeterde betrouwbaarheid van monitoringsplatforms kunnen met thuismonitoring steeds meer relevante parameters worden verkregen. Zo bestaan er bijvoorbeeld testkits voor het analyseren van urine-samples met behulp van een smartphoneapplicatie (afbeelding 1).

Deze app maakt gebruik van Artificial Intelligence (AI) om camerabeelden van de dipstick te analyseren en zo direct een resultaat te geven van de hoeveelheid eiwit in de urine, een maat voor schade aan de nieren. Een ander onderdeel van de standaardzorg voor patiënten met nierfalen is het monitoren van ureum en creatinine in het bloed. Technieken voor het analyseren van bloedsamples die thuis zijn afgenomen hebben de potentie om veel fysieke controles op de polikliniek te voorkomen, maar zijn vooralsnog voornamelijk in ontwikkeling. Er bestaan enkele apparaten die met een enkele bloeddruppel uit een vingerprik creatinine kunnen bepalen, maar studies laten zien dat de resultaten niet nauwkeurig genoeg zijn en dat de gebruiksvriendelijkheid van de apparaten vooralsnog beperkt is [5]. Een techniek die in Nederland al wel veel wordt toegepast, is het meten van de concentratie immunosuppressiva uit opgedroogde bloeddruppels. De patiënt kan met een vingerprik enkele druppels bloed op een papieren kaartje aanbrengen, wat vervolgens opgestuurd wordt naar het ziekenhuis voor analyse. Het monitoren van immunosuppressiva is van groot belang om afstoting van een getransplanteerd orgaan te voorkomen.
Voor het verkrijgen van een volledig beeld van de fysieke status van een patiënt bieden wearables een veelbelovende uitkomst. Recente vooruitgang in met name de micro-elektronica maken het mogelijk om continu diverse vitale functies te monitoren. In veel moderne wearables kunnen verschillende technieken, zoals elektrocardiografie (ECG), photoplethysmografie (PPG) en bioimpedantie, worden gecombineerd.
Bij patiënten met nierfalen komt frequent hyperkaliëmie voor met ernstige hartritmestoornissen als gevolg. Met behulp van algoritmes is het mogelijk om uit een ECG-signaal een hyperkaliëmie te detecteren [6]. Toepassing van dergelijke algoritmes is echter nog niet gevalideerd op deze single-lead ECG-data en wordt dus nog niet klinisch ingezet, maar kan mogelijk in de toekomst een uitkomst bieden ter ondersteuning van interventies ter preventie en behandeling van hyperkaliëmie. PPG is een optische techniek om hartslag te monitoren middels detectie van volumeveranderingen in de perifere bloedsomloop en wordt momenteel veel in commercieel beschikbare wearables toegepast om atriumfibrilleren te detecteren. Daarnaast kan PPG ook worden ingezet om niet-invasieve bloeddrukmetingen zonder manchet te verkrijgen door een geavanceerde analyse van de golfvormen gemeten in perifere bloedvaten. Voor deze toepassing wordt gebruikgemaakt van AI-modellen. Recente studies hebben aangetoond dat met een polsbandje waarin deze techniek werd toegepast de bloeddruk en atriumfibrilleren accuraat konden worden gemeten tijdens hartoperaties [7]. Continue monitoring in de thuissituatie moet nog worden gevalideerd, maar heeft de potentie om bloeddrukregulatie te verbeteren en hypertensie beter te behandelen. Aangezien deze techniek relatieve metingen levert, is regelmatige kalibratie met behulp van een conventionele bloeddrukmeter nog wel vereist. Een techniek die voornamelijk in hartfalen patiëntenpopulatie wordt onderzocht, maar ook van groot belang kan zijn voor patiënten met eindstadium nierfalen, is de zogenaamde ‘bioimpedantiespectroscopie’ (afbeelding 2).
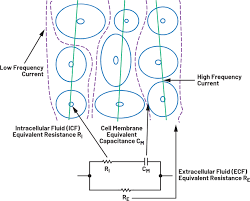
Een techniek die voornamelijk in hartfalen patiëntenpopulatie wordt onderzocht, maar ook van groot belang kan zijn voor patiënten met eindstadium nierfalen, is de zogenaamde ‘bioimpedantiespectroscopie’. Deze techniek biedt inzicht in de veranderingen in de hoeveelheid lichaamswater. Middels huidelektrodes wordt er een lage stroom op verschillende frequenties toegepast. Een celmembraan kan vanwege zijn opbouw uit lipiden en het spanningsverschil binnen en buiten de cel worden gezien als condensator. Op hoge frequenties passeert de stroom de celmembraan en zal zowel door het intracellulair als extracellulair water stromen, in tegenstelling tot de lage frequenties die de celmembraan niet passeren. Gezien de gemeten weerstand omgekeerd evenredig is aan de hoeveelheid vocht, kunnen hieruit zowel de intracellulaire als extracellulaire volumes worden berekend. Longitudinale bioimpedantiemetingen bieden de mogelijkheid vochtverschuivingen tussen de dialysebehandelingen door in beeld te brengen. De validatie van draagbare bioimpedantie tijdens hemodialyse is recent onderzocht [8]. In het LUMC zal komend jaar een studie starten die de toepassing van draagbare bioimpedantie metingen tijdens dialyse verder zal onderzoeken. Het doel is om deze techniek uiteindelijk ook tussen de dialysesessies door te kunnen toepassen. Waar nu nog met elektrodes wordt gewerkt, is het dan van belang dat er een gebruiksvriendelijke patch beschikbaar komt die de patiënt zelf op kan plakken. Een dergelijke patch wordt momenteel ontwikkeld door AIKON Health (afbeelding 3).

Deze patch, waarin de elektrodes verwerkt zijn, maakt langdurige en comfortabele metingen mogelijk. Dit zou patiënten in staat kunnen stellen hun vochtstatus effectiever te beheren en zich beter aan een vochtrestrictie te houden. Bovendien kan de verkregen data bijdragen aan het optimaliseren van dialysebehandelingen. Deze technologie, in combinatie met PPG, biedt de mogelijkheid om de hemodynamische status van patiënten nauwkeuriger te kunnen monitoren.
Wearables die dergelijke data kunnen combineren, dragen bij aan de digitalisatie van klinische gegevens. Deze transitie zal nodig zijn om voor een duurzame zorg. Het verzamelen van informatie in de thuissituatie van een patiënt, zorgt voor het meenemen van individuele verschillen in leefstijl en biologie in het monitoren van ziekteprogressie of tolerantie voor een behandeling. Het verwerken van deze gegevens in klinisch interpreteerbare parameters kan een gedetailleerdere weergave van de gezondheidstoestand van de patiënt genereren. Een voorbeeld hiervan is de combinatie van de fysieke activiteit, gemeten met een stappenteller, en de gemiddelde actieradius, gedetecteerd door het GPS-signaal van een smartphone, dat samen een objectieve indicatie biedt van de fysieke toestand en de mate van maatschappelijke deelname van een patiënt. Dit soort gegevensvisualisatie kan bijdragen aan het gericht aanpassen van leefstijlveranderingen die de ziekteprogressie kunnen vertragen en de behandelresultaten kunnen optimaliseren, met daarbij meer aandacht voor de kwaliteit van leven. Een kanttekening bij een dergelijke benadering is echter de inbreuk op de privacy van de patiënt.
Om deze redenen werkt het LUMC aan de opzet van een studie die gericht is op het selecteren van digitale eindpunten, gemeten in de thuissituatie, voor de voorspelling en preventie van achteruitgang van de patiënt, evenals het identificeren van leefstijldoelen voor dialysepatiënten. Het kwantificeren van uitkomsten bij dialysepatiënten heeft de potentie om waardevolle gegevens te leveren die clinici ondersteunen in het informeren van patiënten over hun verwachtingen van de behandeling. Deze gegevens kunnen tevens worden ingezet als basis voor interventionele onderzoeken en de ontwikkeling van (machinelearning) modellen die fysieke achteruitgang voorspellen. Dit zou het bijvoorbeeld mogelijk maken om een uitkomst, die belangrijk is voor de patiënt, bijvoorbeeld fysieke activiteit in het dagelijks leven, als uitkomstmaat te gebruik in een interventiestudie. Voor deze studie wordt samengewerkt met het Center for Human Drug Research (CHDR) in Leiden, dat een platform genaamd Trial@Home heeft ontwikkeld voor het verzamelen van dergelijke gegevens.
Nu het steeds beter mogelijk wordt om zowel fysiologische als leefstijl-gerelateerde parameters te monitoren die relevant zijn in management van chronisch nierfalen, is de ontwikkeling van geschikte en veilige infrastructuren voor thuismonitoring van groot belang. Bij de implementatie van dergelijke infrastructuur is het cruciaal om de inbreuk op de privacy van patiënten te minimaliseren, vooral bij het gebruik van continue thuismonitoring, en om veilige opslag en overdracht van gegevens te waarborgen. Duurzame zorg vereist een andere organisatie van ons zorgsysteem waarin thuismonitoring een centrale rol zal spelen. Deze benadering zal bijdragen aan de overgang naar meer duurzame gezondheidszorg met minimale milieu-impact en helpen om de groeiende uitdaging van een tekort aan zorgpersoneel aan te pakken door meer zorg naar de thuisomgeving te verplaatsen.
Meer informatie
Bekijk hier de Clinical Outlook in Nature Reviews Nephrology.
Referenties
- 1. Global, regional, and national burden of chronic kidney disease, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet, 2020. 395(10225): p. 709-733.
- 2. Foreman, K.J., et al., Forecasting life expectancy, years of life lost, and all-cause and cause-specific mortality for 250 causes of death: reference and alternative scenarios for 2016-40 for 195 countries and territories. Lancet, 2018. 392(10159): p. 2052-2090.
- 3. Barraclough, K.A. and J.W.M. Agar, Green nephrology. Nat Rev Nephrol, 2020. 16(5): p. 257-268.
- 4. Shore, J., et al., The compliance and cost-effectiveness of smartphone urinalysis albumin screening for people with diabetes in England. Expert Rev Pharmacoecon Outcomes Res, 2020. 20(4): p. 387-395.
- 5. van der Heijden, C., et al., Analytical and clinical performance of three hand-held point-of-care creatinine analyzers for renal function measurements prior to contrast-enhanced imaging. Clin Chim Acta, 2019. 497: p. 13-19.
- 6. Galloway, C.D., et al., Development and Validation of a Deep-Learning Model to Screen for Hyperkalemia From the Electrocardiogram. JAMA Cardiol, 2019. 4(5): p. 428-436.
- 7. Edgar, R., et al., Automated cardiac arrest detection using a photoplethysmography wristband: algorithm development and validation in patients with induced circulatory arrest in the DETECT-1 study. Lancet Digit Health, 2024. 6(3): p. e201-e210.
- 8. Schoutteten, M.K., et al., The Feasibility of Semi-Continuous and Multi-Frequency Thoracic Bioimpedance Measurements by a Wearable Device during Fluid Changes in Hemodialysis Patients. Sensors (Basel), 2024. 24(6).