Wanneer patiënten met chronische neurologische aandoeningen niet meer met medicatie behandeld kunnen worden, kunnen ze nog wel baat hebben bij een behandeling met neuromodulatie. Neuromodulatie is de overkoepelde naam voor (invasieve) technieken waarbij met elektrische of magnetische stimulatie de werking van het zenuwstelsel wordt beïnvloed.
Inleiding
In de kliniek is verreweg de meest toegepaste vorm van neuromodulatie ruggenmergstimulatie (Spinal Cord Stimulation) voor de behandeling van chronische neuropathische pijn. Per jaar worden er wereldwijd ruim 50.000 SCS systemen geïmplanteerd (figuur 1).
Bij ruggenmergstimulatie wordt onder lokale verdoving, door de anesthesioloog of neurochirurgeen stimulatie-elektrode in de epidurale ruimte gebracht zodat de zenuwbanen aan de achterzijde van het ruggenmergmet elektrische pulsen worden gestimuleerd. De elektrode wordt onderhuids verbonden met een programmeerbare pulsgenerator die meestal in de bil of buikwand wordt geplaatst. Het stimuleren van de achterstrengen van het ruggenmerg zorgt voor een blokkade van de chronische pijnsignalen op het niveau van het ruggenmerg en de pijn wordt daardoor minder of soms zelfs helemaal niet meer gevoeld. Daarvoor in de plaats wordt vaak wel paresthesie -een ander gevoel- waargenomen, meestal in de vorm van tintelingen.
Paresthesie
Die tintelingen die als gevolg van de stimulatie gevoeld worden, worden gevoeld in die delen van het lichaam die worden voorzien door de zenuwbanen die gestimuleerd worden. Idealiter wordt de paresthesie dus gevoeld in precies dat deel van het lichaam waar ook de pijn gevoeld wordt. Vandaar dat de implantatie dan ook bijna altijd onder lokale verdoving plaatsvindt, zodat de patiënt wakker is tijdens de procedure en zelf kan aangeven waar hij de pijn en de paresthesie voelt.
In het algemeen wordt de paresthesie goed verdragen door de meeste patiënten. Sommige patiënten geven als uitleg dat niet-pijnlijke tintelingen min of meer genegeerd kunnen worden, terwijl pijn voortdurend om aandacht blijft vragen. Hoe mensen de tintelingen als gevolg van de stimulatie voelen en beoordelen, varieert echter sterk van patiënt tot patiënt. Door aanpassingen aan de stimulatiepulsen kan het waargenomen gevoel tot op zekere hoogte veranderd worden.
Zowel toename in de amplitude als de pulsduur zorgt er meestal voor dat een patiënt de stimulatie als harder ervaart, waarbij een heel harde stimulatie onaangenaam of zelfs pijnlijk kan zijn. Daarnaast kan met toenemende amplitude of pulsduur, door het afgeven van meer energie en rekruteren van meer zenuwbanen, ook een groter lichaamsgebied bereikt worden.
Door de stimulatiefrequentie aan te passen kan de kwaliteit van de sensatie veranderen. Als er met een relatief hoge frequentie gestimuleerd wordt, worden de tintelingen vaak als gladder of kriebeliger ervaren dan wanneer er met een lagere frequentie wordt gestimuleerd. Op het moment variëren de stimulatiefrequenties die het meest bij patiënten worden gebruikt van 30 tot 80 Hz en kunnen de meeste standaard stimulatoren frequenties van 2 tot 300 Hz leveren.
Paresthesie-vrij
Nu de batterijcapaciteit van de pulsgeneratoren toeneemt en er meer en meer oplaadbare pulsgeneratoren beschikbaar komen, wordt het mogelijk nieuwe stimulatievormen die meer van de pulsgeneratoren vragen aan te bieden, waaronder intermitterende stimulatie en stimulatie met frequenties tot 10 kHz. Als een van de belangrijkste redenen voor deze nieuwe stimulatievormen wordt door al de verschillende fabrikanten genoemd dat ze paresthesie-vrij zijn; patiënten voelen de stimulatie niet meer.
Voor patiënten die de paresthesie sowieso als onaangenaam ervaren is dat een groot voordeel. Daarnaast zijn er patiënten bij wie de paresthesie erg houdingsafhankelijk is. Zij voelen dan bij bepaalde houdingen of bewegingen de stimulatie opeens heel hard. In ieder geval voor deze patiënten, maar mogelijk voor iedereen, zou het fijn zijn om wél de pijnstillende werking van de stimulatie te hebben, maar de stimulatie zelf niet meer te voelen. Mits de effectiviteit natuurlijk minimaal net zo goed is als die van conventionele stimulatie.
Onderzoek burst-stimulatie
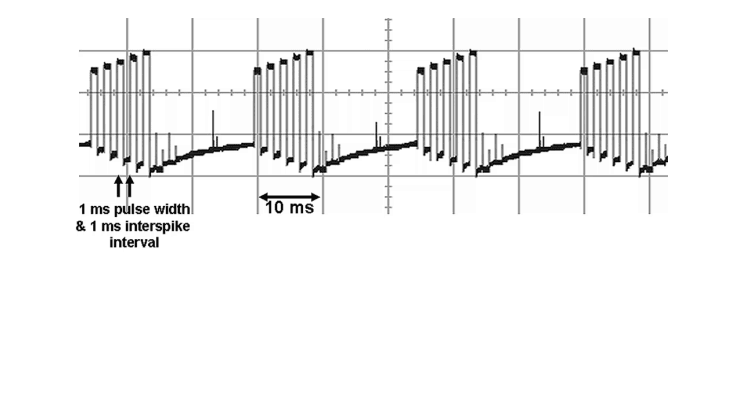
Een van de nieuwe paresthesie-vrije stimulatievormen is burst-stimulatie [1]en deze stimulatievorm kan experimenteel al wel in oudere stimulatoren van St. Jude Medical geprogrammeerd worden. Burst-stimulatie is een soort combinatie van ‘gewone’ stimulatie en hoog frequente stimulatie, waarbij met 40 Hz een ‘burst’ bestaande uit 5 pulsen met een frequentie van 500 Hz aan het ruggenmerg worden afgegeven (figuur 2).
Om de effectiviteit van burst-stimulatie te bepalen in vergelijking met conventionele stimulatie, hebben we in het Medisch Spectrum Twente in Enschede onderzocht hoe burst-stimulatie beoordeeld wordt door mensen die al een ruggenmergstimulator hebben [2]. Zesendertig patiënten van het Medisch Spectrum Twente hebben aan de studie meegedaan. Dit waren patiënten of met lage rug- en beenpijn (FBSS) of met diabetische neuropathische pijn die allemaal al eens eerder aan een onderzoek hadden meegewerkt. Alle patiënten hebben twee weken lang burst-stimulatie uitgeprobeerd en gemiddeld hadden de deelnemers aan de studie 2,5 jaar ervaring met ruggenmergstimulatie, maar iedereen had in ieder geval minstens 1 jaar een stimulator. Bijgehouden is hoeveel pijn iedereen had voorafgaand aan de implantatie van de ruggenmergstimulator, hoeveel pijn iedereen had met de eigen (conventionele) stimulatie op het moment van inclusie in de studie en hoeveel pijn iedereen had gedurende twee weken met burst-stimulatie. Daarnaast is ook bijgehouden hoe de pijn en de conventionele en nieuwe stimulatievorm ervaren werden en of er eventuele bijwerkingen van de stimulatie waren.
Resultaten
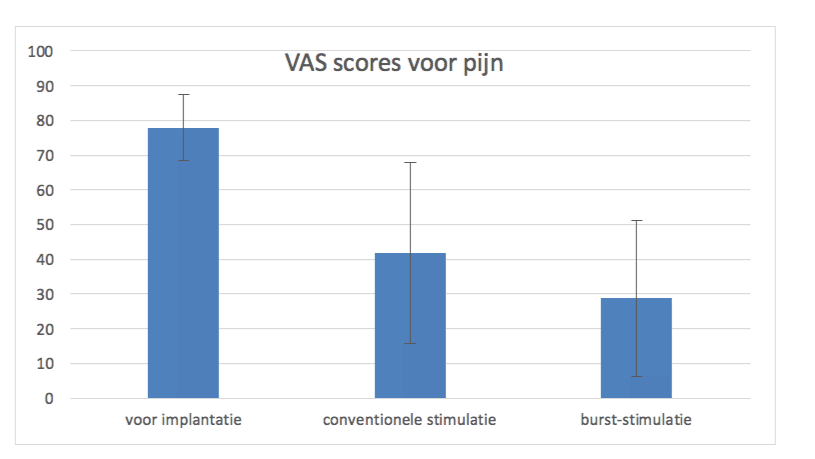
De evaluatie van de verzamelde data laat zien dat mensen met hun conventionele stimulatie ook na gemiddeld 2.5 jaar nog steeds veel minder pijn (VAS pijnscore 42/100) hebben dan voor implantatie van de stimulator (VAS pijnscore 78/100), dus dat de effecten van de (conventionele) stimulatie duurzaam zijn (figuur 3).
Daarnaast geven 21 van de 36 patiënten aan nog minstens 20% extra pijnvermindering te hebben met burst-stimulatie. Vier patiënten hebben daarentegen juist meer pijn met burst-stimulatie en voor 11 patiënten maakt het nauwelijks of geen verschil welke stimulatievorm ze hebben. De gemiddelde VAS pijnscore voor burst-stimulatie komt daardoor op 29/100.
Zeker niet voor iedereen, maar voor veel patiënten was een bijkomstig voordeel van burst-stimulatie dat er geen paresthesie gevoeld werden. De conventionele stimulatie werd door alle patiënten wel waargenomen als tintelingen, maar lang niet iedereen vond dat een onaangenaam gevoel. Tien van de 36 patiënten hebben aangegeven de paresthesie juist aangenaam te vinden en zowel het gevoel zelf als de controle over dat gevoel te missen tijdens de burst-stimulatie. In tegenstelling tot conventionele stimulatie is burst-stimulatie namelijk (voorlopig nog) niet harder of zachter te zetten door de patiënt zelf, ook niet als de pijn op een bepaald moment toe- of afneemt.
Voor enkele patiënten was het missen van de paresthesie zelfs een zwaarder wegend aspect dan de grotere pijnreductie die ze met burst-stimulatie hadden. Daarnaast meldden paar patiënten dat het voelen de paresthesie voor hen een mogelijkheid was om de aandacht te richten op iets anders in hun lichaam dan de pijn. Alles in overwegingnemend hadden uiteindelijk 15 patiënten een voorkeur voor conventionele stimulatie en 20 patiënten voor burst-stimulatie.
Het klinisch en psychologisch belang van een gevoel dat aangeeft dat de ruggenmergstimulator aanstaat, dat door een deel van de patiënten met een stimulator genoemd wordt, is door fabrikanten van paresthesie-vrije stimulatie waarschijnlijk niet voorzien. Patiënten gaan een intieme relatie met de ruggenmergstimulator aan wanneer de technologie een onderdeel van hun lichaam wordt en het incorporeren van de paresthesie is daar bij veel patiënten een belangrijk onderdeel van [3,4]. De manier waarop een stimulator geïncorporeerd wordt verschilt van patiënt tot patiënt. Inzicht in de verschillende manieren waarop de relaties tussen patiënt en stimulator vorm krijgen, is noodzakelijk om de technologische ontwikkeling en de behandeling met ruggenmergstimulatie verder te kunnen optimaliseren en personaliseren.
Conclusie
Nieuwe stimulatievormen bieden betere pijnreductie voor een deel van de patiënten met een ruggenmergstimulator en daarnaast worden de mogelijkheden van paresthesie-vrije stimulatie door een deel van de patiënten zeer gewaardeerd.
Echter, chronische pijn is een complexe aandoening en de chronische pijnpatiënt bestaat niet. Er is een heel grote variatie in hoe patiënten op ruggenmergstimulatie reageren en fabrikanten van ruggenmergstimulatoren doen er goed aan in iedere pulsgenerator een grote diversiteit aan stimulatievormen mogelijk te maken, zodat patiënten betere stimulatie op maat aangeboden kan worden.
Referenties
[1] D de Ridder et al, Burst spinal cord stimulation: Towardparesthesia-free pain suppression. Neurosurgery, 2010, vol 66, pp 101–108.
[2] C de Vos et al, Burst spinal cord stimulation evaluated in patients withfailed back surgery syndrome and painful diabetic neuropathy. Neuromodulation, 2014, vol 17, pp 152-159.
[3] C de Vos, Spinal cord stimulation and modulation of neuropathic pain, proefschrift Universiteit Twente, 2013.
[4] L Dalibert, Posthumanism and Somatechnologies Exploring the Intimate Relations between Humans and Technologies, proefschrift Universiteit Twente, 2014.