Een MR-beeld maken en gelijktijdig de zichtbare tumor kunnen bestralen; dit was tientallen jaren geleden het droomscenario voor radiotherapeutische behandelingen. Dankzij het doorzettingsvermogen van een aantal knappe koppen is deze techniek inmiddels ontwikkeld tot een commercieel product: de MR-linac.
Technische uitdagingen
Door een MR-beeld te maken tijdens de radiotherapeutische behandeling is het mogelijk om de tumor met grote precisie te bestralen, waardoor de behandeling van de tumor zal verbeteren en het omliggende gezonde weefsel beter kan worden gespaard. Het onderzoek naar het combineren van een MRI-apparaat met een bestralingstoestel (linac) heeft zijn oorsprong in Utrecht. Daar werd in de jaren negentig het eerste proof of concept getest en verder doorontwikkeld tot een prototype [1].
De ontwikkeling van dit prototype bracht een tweetal technische uitdagingen met zich mee. De eerste uitdaging was het effect dat het magneetveld van de MRI heeft op de geladen deeltjes in de linac. In aanwezigheid van het magneetveld zullen deze geladen deeltjes worden afgebogen door de Lorentzkracht. In het toestelontwerp van de huidige MR-linac’s is middels passieve of actieve afscherming lokaal het magneetveld bij de linac geminimaliseerd waardoor het pad van de geladen deeltjes niet meer wordt beïnvloed.
De tweede technische uitdaging zijn RF-verstoringen afkomstig van verschillende componenten in het bestralingstoestel. Om een MR-beeld te verkrijgen wordt er gebruikgemaakt van de RF-signalen die de aangeslagen waterstofatomen in het weefsel uitzenden. Dit zijn zeer zwakke signalen die versterkt moeten worden om een MR-beeld te maken. RF-verstoringen dienen dus geminimaliseerd te worden om een zo scherp mogelijke afbeelding van het weefsel te kunnen maken. Met een kooi van Faraday is het mogelijk om RF-signalen af te schermen. In het toestelontwerp kan dit enerzijds worden gedaan door het gehele bestralingstoestel in een aparte kooi van Faraday te plaatsen, anderzijds door de individuele componenten lokaal af te schermen door ze te voorzien van eigen Faraday kooitjes.
Toepassingen
De CT is jarenlang de gouden standaard geweest voor beeldvorming bij radiotherapeutische behandelingen. Voorafgaand aan de behandeling wordt het doelgebied en omliggende weefsels in kaart gebracht op de CT en wordt er op basis hiervan een bestralingsplan gemaakt. In dit bestralingsplan wordt er gestuurd om een hoge dosis op de tumor te geven maar een minimale dosis op het omliggende gezonde weefsel. De behandeling wordt vaak over meerdere dagen verspreid gegeven, waarbij de patiënt iedere keer op dezelfde wijze wordt gepositioneerd als op de CT. Deze positie wordt dagelijks gecontroleerd op het bestralingstoestel via een cone beam-CT.
Om rekening te houden met de onzekerheden van de behandeling wordt er bij het maken van een bestralingsplan gebruikgemaakt van een marge rondom de tumor. In deze marge zijn onzekerheden verwerkt zoals beweging van de tumor en geometrische onnauwkeurigheden in de beeldvorming. Door gebruik te maken van een MRI-beeld in plaats van een CT-beeld is de tumor vaak beter te onderscheiden (Figuur 1) en wordt de onzekerheid van de behandeling gereduceerd. Voorbeelden hiervan zijn de behandeling van tumoren in o.a. de pancreas, nieren, lever en klieren [2].
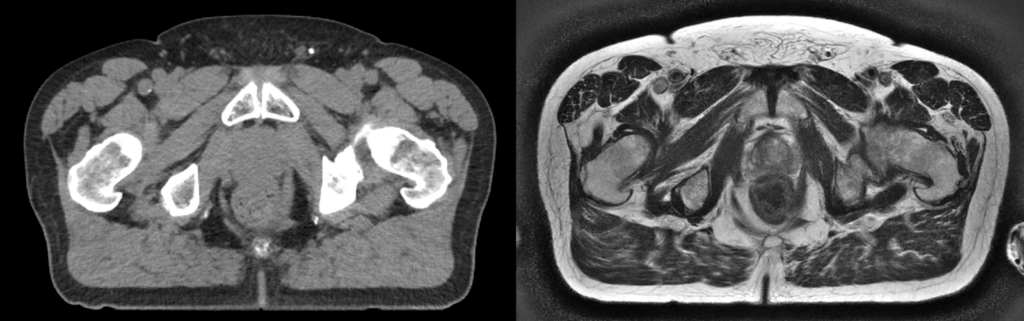
Een verdere margereductie kan worden toegepast als de tumor en het omliggende weefsel tijdens de behandeling in beeld wordt gebracht. Waar bij een traditionele radiotherapeutische behandeling hetzelfde bestralingsplan iedere fractie opnieuw wordt gegeven, is het nu mogelijk dagelijks een adaptief bestralingsplan te maken op basis van de actuele MR-beelden. Hierbij wordt er in het adaptieve bestralingsplan rekening gehouden met de dagelijkse anatomische variaties, zoals bijvoorbeeld wisselende darm- of blaasvulling (Figuur 2). Ook wordt de straling op het omliggende gezonde weefsel gereduceerd.

Er wordt niet alleen rekening gehouden met de dagelijkse variaties, maar er kan ook tijdens de bestraling met real-time MR-beelden worden meegekeken naar de tumor en de omliggende organen. Als er onverwachte bewegingen worden gedetecteerd, bijvoorbeeld door darmperistaltiek of ademhalingsbewegingen, kan de bestraling binnen een halve seconde automatisch worden gepauzeerd. Omdat er zeer kleine marges worden gebruikt, gebeurt dit al bij een verplaatsing van slechts enkele millimeters. In sommige gevallen, zoals bij bestralingen van longtumoren, wordt het real-time beeld ook aan de patiënt getoond. Hierdoor kan de patiënt zelf, middels het controleren van de ademhaling, de tumor naar de juiste positie bewegen (Figuur 3).
De toekomst
Op de huidige MR-linac toestellen kunnen tumoren goed in beeld worden gebracht door een verbeterd contrast van de MR-beelden ten opzichte van de CT-beelden. Door te adapteren naar de dagelijkse anatomie en tijdens het bestralen de bestralingsbundel aan- of uit te schakelen, kan de dosis met een zeer hoge nauwkeurigheid worden gegeven. Hierdoor wordt het mogelijk om met steeds minder marge de tumor te bestralen en daarbij het omliggende gezonde weefsel te sparen.
De ontwikkelingen rondom de MR-linac staan zeker niet stil en er zullen de komende jaren nog veel meer innoverende toepassingen in de kliniek worden geïntroduceerd. De grootste uitdaging is om de behandeling te versnellen. De verwachting is dat AI hier een grote rol in zal gaan spelen [3]. Het is aan de huidige generatie knappe koppen om ook hiervoor de technische uitdagingen aan te gaan.
Referenties
- J.W. Lagendijk et al – The magnetic Resonance Imaging-linac system – Seminars in Radiation Oncology (2014)
- A. Ocanto et al – MR-linac, a new partner in radiation oncology: Current landscape – Cancers (2024)
- Landry et al – The role of AI in radiotherapy clinical practice – BJR open (2023)







Een goed inhoudelijk leesbaar, interessant artikel!!