Kinderen met cerebrale parese (CP) hebben vaak problemen met lopen. Verschillende onderliggende stoornissen kunnen hier de oorzaak van zijn, wat het moeilijk maakt om de best passende behandeling te kiezen. De afgelopen jaren hebben we in een internationaal samenwerkingsproject bij het Amsterdam UMC en Griffith University (Australië) onderzoek gedaan naar het gebruik van computersimulaties met spierskeletmodellen om beter vast te kunnen stellen welke stoornissen de loopproblemen van een kind veroorzaken.
Gangbeeldanalyses bij kinderen met cerebrale parese
Cerebrale parese (CP) is de meest voorkomende motorische stoornis bij kinderen, die ongeveer 1 op 500 pasgeborenen treft [1], als gevolg van hersenbeschadiging voor de eerste verjaardag. Kinderen met CP ontwikkelen vaak loopproblemen, zoals bijvoorbeeld tenenlopen, of lopen met te veel gebogen knieën. Dit leidt tot meer vermoeidheid tijdens het lopen, en kan uiteindelijk de participatie en kwaliteit van leven verminderen. Verschillende stoornissen in het neurale, spier-, of skeletsysteem kunnen de onderliggende oorzaak van de loopproblemen zijn. Zo hebben kinderen met CP vaak last van spasticiteit, wat ertoe leidt dat een spier ongecontroleerd samentrekt wanneer deze snel wordt opgerekt. Andere stoornissen zijn spierzwakte en spierverkorting, en uiteindelijk ook afwijkingen in de botten door de abnormale belasting tijdens de groei.
Om beter te begrijpen welke stoornissen precies de loopproblemen van een kind veroorzaken, wordt in de revalidatiegeneeskunde vaak een gangbeeldanalyse gedaan (Figuur 1). Hierbij worden de gewrichtshoeken, gewrichtsmomenten en spieraanspanning tijdens het lopen gemeten. Voor een gangbeeldanalyse worden reflectieve markers op botpunten geplakt, waarvan de positie tijdens het lopen gemeten wordt door infraroodcamera’s. Hieruit kunnen de gewrichtshoeken tijden het lopen worden berekend. Door ook de grondreactiekracht te meten kunnen daarnaast gewrichtsmomenten, een maat voor de belasting van een gewricht, worden berekend. Spieraansturing wordt gemeten door sensoren op de spieren te plakken. Deze dankzij computersimulatiesmeten de elektrische signalen die naar de spieren gestuurd worden. In combinatie met een lichamelijk onderzoek, waarin spasticiteit en het bewegingsbereik van gewrichten wordt gemeten, kan inzicht verkregen worden in welke stoornissen nu precies bijdragen aan de loopproblemen van een kind.
Een gangbeeldanalyse kan echter niet altijd volledig bepalen welke stoornis de grootste bijdrage aan de loopbeperking levert. Relevante uitkomstmaten, zoals spierlengtes, spierkrachten en gewrichtsbelasting, kunnen niet direct gemeten worden. Deze maten zijn echter wel van belang voor het kiezen van de juiste behandeling, aangezien de beste behandeling om de loopproblemen op te lossen afhangt van welke stoornis de loopproblemen veroorzaakt. Het selecteren van de meest geschikte behandeling blijft dan vaak nog steeds een uitdaging.

Computersimulaties met spierskeletmodellen
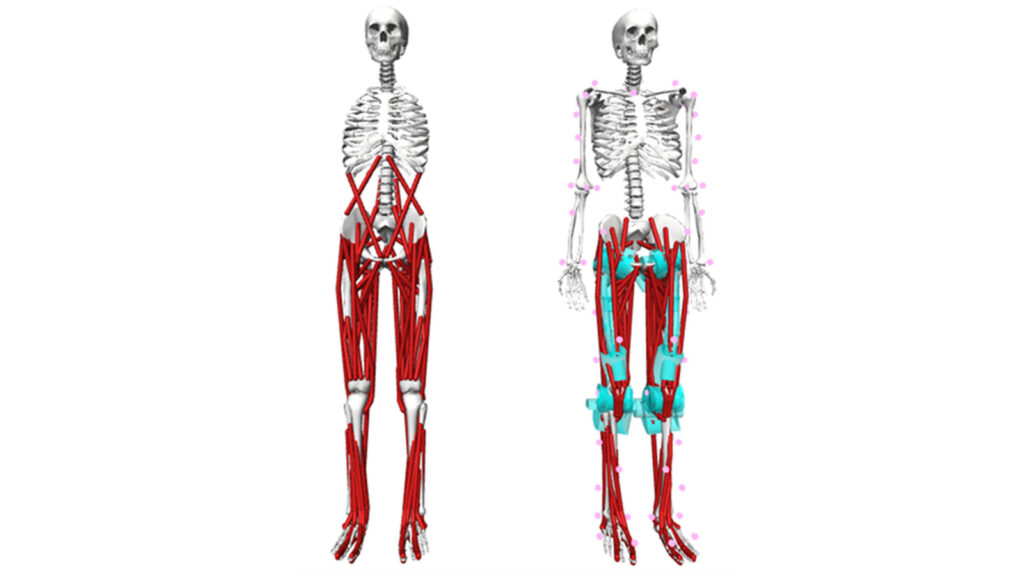
Met spierskeletmodellen kunnen we deze relevante uitkomstmaten wel berekenen. Deze modellen stellen een versimpelde representatie van de botten, spieren en spieraansturing van een mens voor (Figuur 2). Door de wiskundige beschrijving van alle componenten van het model, stellen spierskeletmodellen ons in staat om variabelen te schatten die moeilijk of niet te meten zijn in een experimentele setting. Met behulp van inverse simulaties kunnen variabelen als spierpeeslengtes, spierpeeskrachten en gewrichtscontactkrachten geschat worden met de markerposities en grondreactiekrachten vanuit de gangbeeldanalyse. Bovendien kunnen voorspellende, voorwaartse simulaties inzicht geven in directe oorzaak-gevolgrelaties tussen een stoornis en de daardoor veroorzaakte loopproblemen. Uiteindelijk kunnen uitkomsten van zulke simulaties mogelijk de behandelkeuze beter informeren om zo het lopen van kinderen met CP te verbeteren.
Huidige veelgebruikte simulatiemethoden zijn echter niet representatief voor kinderen met CP, aangezien ze gebaseerd zijn op de botten, de spieren en de spieraansturing van gezonde volwassenen. Bovendien missen voorspellende simulatiemethoden met gemodelleerde stoornissen vaak validatie met experimentele data, waardoor de evaluaties van de effecten van deze stoornissen op het lopen beperkt betrouwbaar zijn. Het doel van het onderzoek beschreven in mijn proefschrift was dan ook het ontwikkelen, personaliseren en toepassen van simulaties om te verhelderen hoe verschillende stoornissen het lopen bij een kind met CP beïnvloeden. Deel één focuste op personalisatie van de gebruikte spierskeletmodellen en deel twee op de toepassing van voorspellende simulaties.
Personalisatie van de simulatie
Het eerste deel van dit onderzoek was gericht op personalisatie van gangbare simulatiemethoden, waarbij de botten, de spieren en de spieraansturing worden afgestemd op een individu (Figuur 3). Zo werd de Torsion Tool ontwikkeld om de botten van het model te personaliseren op basis van de gemeten botdraaiing van een persoon. Gepersonaliseerde bovenbeenbotten bleken representatiever te zijn voor de werkelijke bovenbeenbotten van gezond ontwikkelende kinderen én van kinderen met CP dan het standaard gebruikte bovenbeenbot in het model [4]. Ook werden spierparameters gepersonaliseerd door spierkrachten en spierlengtes van het model te matchen aan gemeten waarden. De aanpassingen waren significant verschillend tussen gezonde kinderen en kinderen met CP, waarbij de standaardwaarden in het model niet nauwkeurig waren [5]. Daarnaast werd het personaliseren van de spieraansturing toegepast door gemeten spieraansturing als input mee te geven aan het model. Dit had een grote invloed op de gesimuleerde spierkrachten, vooral bij kinderen met CP [6]. Over het algemeen resulteerde elk van de personalisatiemethoden in een patiënt-specifiek model dat meer consistent was met experimentele metingen dan het standaardmodel, en daarmee is de kans groter dat de uitkomsten fysiologisch correcter zijn.

Oorzaak-effectrelaties stoornissen en loopafwijkingen
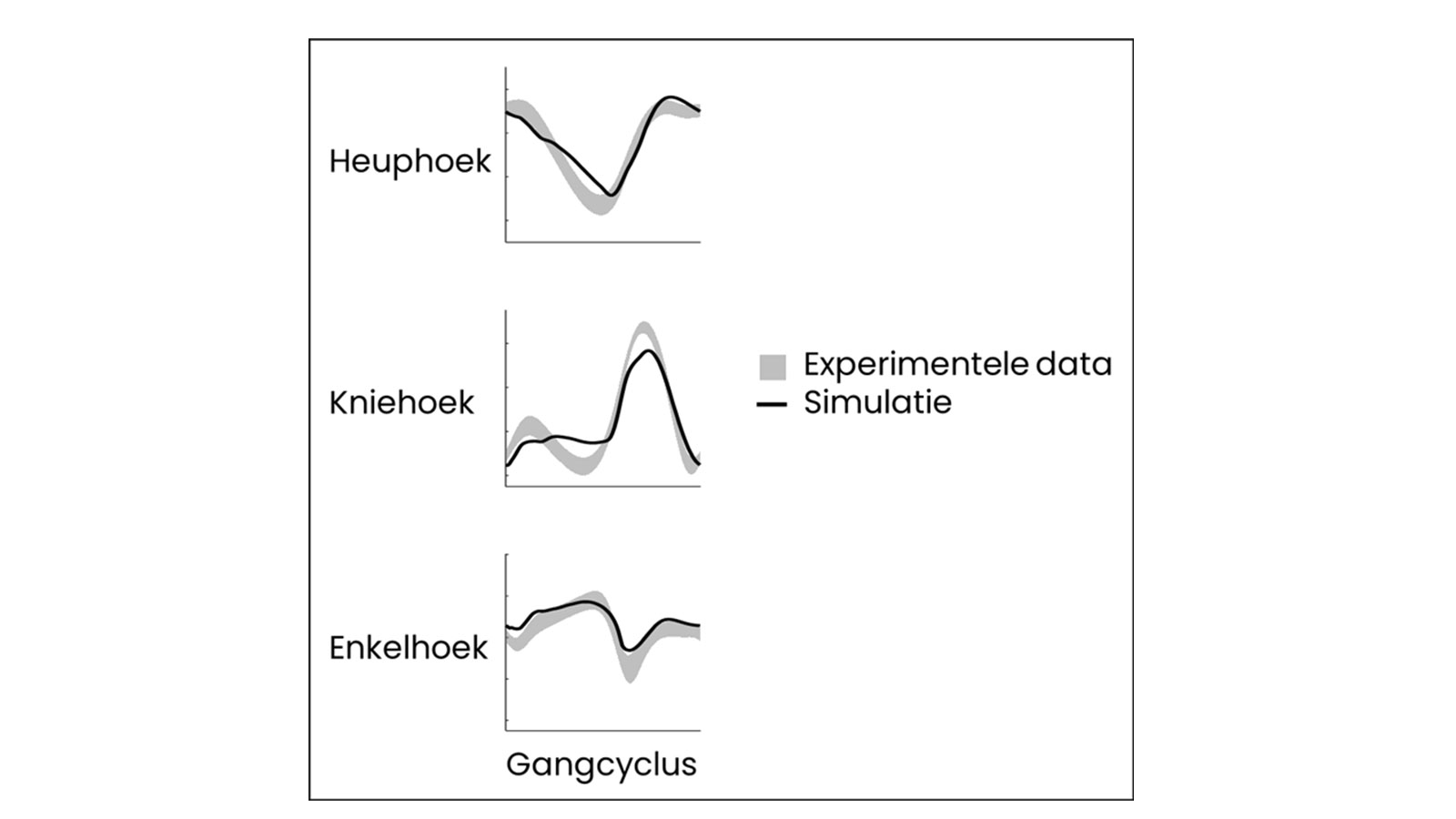
In het tweede deel van dit onderzoek zijn voorspellende simulaties ontwikkeld en toegepast om de effecten van stoornissen op het lopen te onderzoeken. Er werd een raamwerk voor voorspellende simulaties ontwikkeld, waarin optimalisatiecriteria op een zorgvuldige manier werden gecombineerd en gewogen om gezond lopen zo goed mogelijk te voorspellen. Optimalisatie van gebruikte energie per meter speelde de grootste rol, gevolgd door respectievelijk hoofdstabiliteit, voet-grondimpact, spieractivatie en het voorkomen van kniehyperextensie (te veel opstrekken van de knie). Hiermee werd gezond lopen beter voorspeld dan tot dan toe in de literatuur was te vinden (Figuur 4) [7].
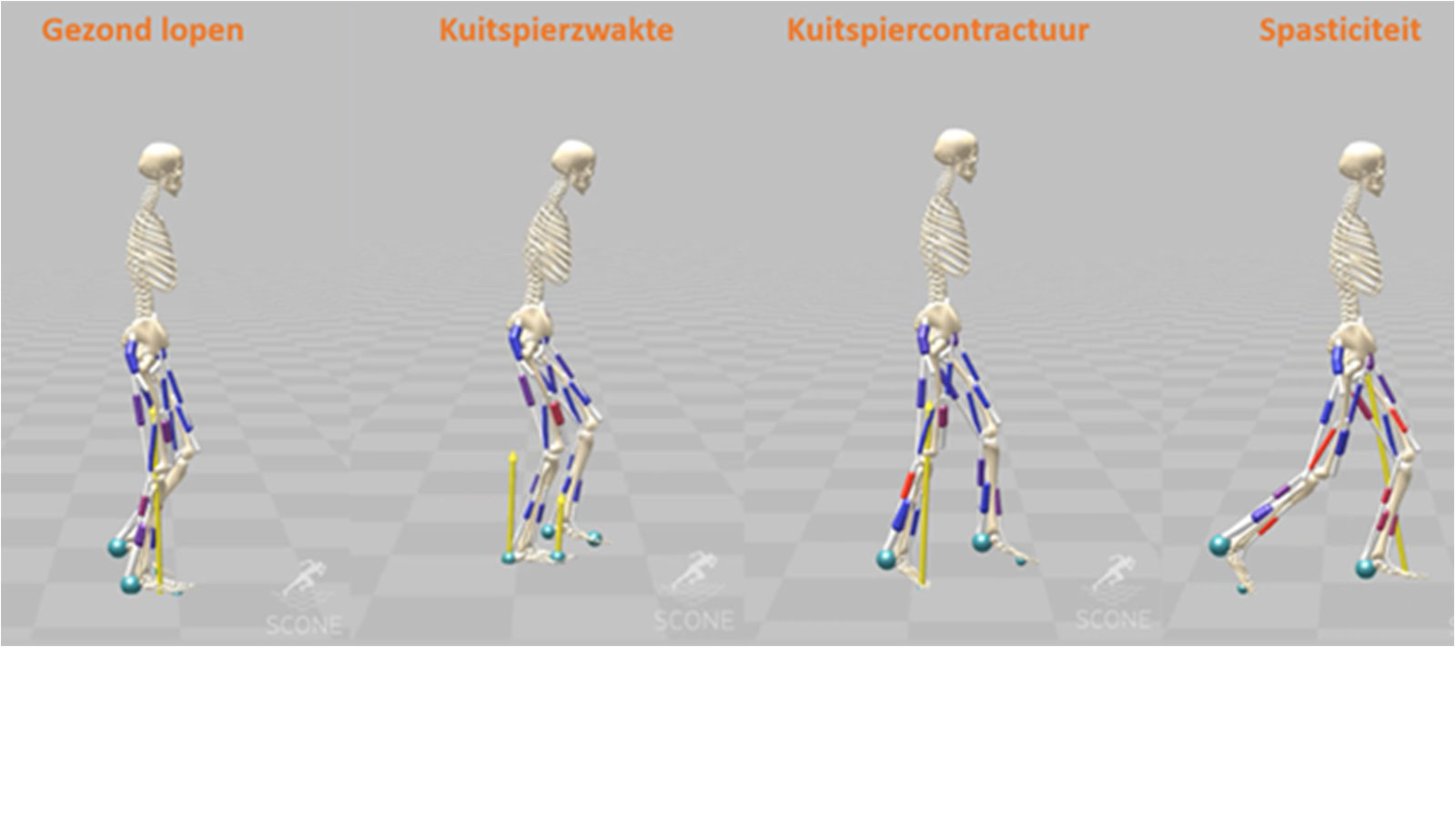
Vervolgens werden stoornissen toegevoegd aan het ontwikkelde raamwerk, namelijk kuitspierzwakte, kuitspiercontractuur (=spierverkorting), en spasticiteit. Door het raamwerk opnieuw te optimaliseren met elk van deze stoornissen, kon het effect van elke stoornis op het lopen voorspeld worden (Figuur 5). Het voorspelde looppatroon werd vergeleken met experimentele data van patiënten met deze specifieke stoornis, zoals bijvoorbeeld door de gewrichtshoeken te vergelijken. Voor elke stoornis kwam de voorspellende simulatie goed overeen met de experimentele data. Kuitspierzwakte leidde vooral tot een verlate afzet van de enkel, en bij het stapsgewijs introduceren van kuitspierzwakte in het model kwamen pathologische loopafwijkingen vooral naar voren wanneer de kuitspieren meer dan 60% verzwakt werden [8]. Kuitspiercontractuur leidde tot een tenenlooppatroon, waarbij de kuitspieren overmatig actief waren. Deze simulaties bieden dus inzichten in hoe een contractuur in combinatie met veranderde spieraansturing zou kunnen bijdragen aan tenenlopen [9]. Bij het toevoegen van spasticiteit werden drie looppatronen voorspeld die vaak worden gezien bij kinderen met spasticiteit. Binnen elk looppatroon waren andere spieren spastisch, wat bruikbare informatie geeft voor het gericht behandelen van de juiste spieren wanneer een kind een bepaald looppatroon laat zien [10]. De voorspellende simulaties in het tweede deel van het onderzoek gaven dus nieuwe inzichten over de effecten van neurale en spier-specifieke stoornissen op het lopen.
Conclusie
Binnen dit onderzoek hebben we simulaties ontwikkeld, gepersonaliseerd en toegepast, om te verhelderen hoe stoornissen het lopen bij kinderen met CP beïnvloeden. Skeletgeometrie, spierpeesgedrag en spieraansturing werden gepersonaliseerd door modelparameters aan te passen zodat ze beter overeenkwamen met patiënt-specifieke gegevens. Daarnaast maakten voorspellende simulaties het mogelijk om de effecten van spierzwakte, spierverkorting en spasticiteit op het lopen te evalueren. Deze evaluaties verhelderden hoe specifieke loopafwijkingen kunnen worden veroorzaakt door specifieke stoornissen. Vervolgstudies zouden moeten werken aan het verder verbeteren van de klinische toepasbaarheid van simulaties door te onderzoeken welk niveau van modelpersonalisatie noodzakelijk is voor klinisch gebruik. Uiteindelijk zal dit de klinische toepassing van simulaties verbeteren, zodat simulaties in de kinderrevalidatiegeneeskunde, kinderorthopedie en kinderneurologie gebruikt kunnen worden om patiënt-specifieke behandelresultaten te indiceren, met als ultiem doel om loopproblemen van kinderen met CP zoveel mogelijk te verminderen.
Dankwoord
Het beschreven onderzoek is uitgevoerd op het Amsterdam UMC en Griffith University (Australië) en dit artikel is mede tot stand gekomen door het begeleidingsteam bestaande uit dr. Marjolein van der Krogt, prof.dr.ir. Jaap Harlaar, dr. Chris Carty, en prof.dr. David Lloyd, en door de diverse coauteurs op de artikelen.
Referenties
- Cans C. Surveillance of cerebral palsy in Europe: a collaboration of cerebral palsy surveys and registers. Dev Med Child Neurol. 2000;42: 816–824.
- Delp SL, Loan JP, Hoy MG, Zajac FE, Topp EL, Rosen JM. An interactive graphics-based model of the lower extremity to study orthopaedic surgical procedures. IEEE Trans Biomed Eng. 1990;37: 757–767.
- Rajagopal A, Dembia CL, DeMers MS, Delp DD, Hicks JL, Delp SL. Full-body musculoskeletal model for muscle-driven simulation of human gait. IEEE Trans Biomed Eng. 2016;63: 2068–2079. doi:10.1109/TBME.2016.2586891
- Veerkamp K, Kainz H, Killen BA, Jónasdóttir H, van der Krogt MM. Torsion Tool: An automated tool for personalising femoral and tibial geometries in OpenSim musculoskeletal models. J Biomech. 2021;125: 110589. doi:10.1016/j.jbiomech.2021.110589
- Veerkamp K, van der Krogt MM, Harlaar J, O’Brien TD, Kalkman BM, Seth A, et al. Personalisation of plantarflexor musculotendon model parameters in children with cerebral palsy. Ann Biomed Eng. 2022. doi:10.1007/s10439-022-03107-8
- Veerkamp K, Schallig W, Harlaar J, Pizzolato C, Carty CP, Lloyd DG, et al. The effects of electromyography-assisted modelling in estimating musculotendon forces during gait in children with cerebral palsy. J Biomech. 2019;92: 45–53. doi:10.1016/j.jbiomech.2019.05.026
- Veerkamp K, Waterval NFJ, Geijtenbeek T, Carty CP, Lloyd DG, Harlaar J, et al. Evaluating cost function criteria in predicting healthy gait. J Biomech. 2021;123: 110530. doi:10.1016/j.jbiomech.2021.110530
- Waterval NFJ, Veerkamp K, Geijtenbeek T, Harlaar J, Nollet F, Brehm MA, et al. Validation of forward simulations to predict the effects of bilateral plantarflexor weakness on gait. Gait Posture. 2021;87: 33–42. Available: https://doi.org/10.1016/j.gaitpost.2021.04.020
- Veerkamp K, van der Krogt MM, Waterval NFJ, Geijtenbeek T, Walsh HPJ, Harlaar J, et al. Predictive simulations identify potential neuromuscular contributors to idiopathic toe walking. Clin Biomech. 2024;111: 106152. doi:10.1016/j.clinbiomech.2023.106152
- Veerkamp K, Carty CP, Waterval NFJ, Geijtenbeek T, Buizer AI, Lloyd DG, et al. Predicting Gait Patterns of Children With Spasticity by Simulating Hyperre fl exia. J Appl Biomech. 2023; 1–13.