Irreversibele elektroporatie (IRE) is een nieuwe, beeldgestuurde tumorablatietechniek waarvan het werkingsmechanisme primair gebaseerd is op een niet-thermische vorm van celdestructie. Het werkingsmechanisme berust op de toediening van meerdere hoog-voltage elektrische pulsen waardoor er gaatjes van 100-150 nanometer in de celmembranen ontstaan. Cellen verliezen hierdoor hun homeostatische eigenschappen en gaan in apoptose.
Inleiding
De laatste twee decennia heeft beeldgestuurde tumorablatie veel aandacht gekregen als behandeloptie voor tumoren die niet of moeilijk resectabel zijn. De explosieve ontwikkeling van verschillende ablatietechnieken heeft geleid tot een voortdurende groei van behandelmogelijkheden. Tegenwoordig is lokale tumorablatie aanvaard als een waardevolle aanvulling op de traditionele behandelingen zoals chirurgische resectie, chemotherapie en radiotherapie. Voornamelijk thermische ablatietechnieken, zoals radiofrequente ablatie (RFA), microwave ablatie (MWA) en cryoablatie worden toegepast als behandeling voor primaire en secundaire lever-, long- en niertumoren.
De ligging van sommige niet-resectabele tumoren kan echter tot gevolg hebben dat thermische ablatie gepaard gaat met een aanzienlijk risico op complicaties. Bij deze technieken wordt namelijk niet alleen het tumorweefsel vernietigd, maar ook het gezonde weefsel eromheen. Kwetsbare structuren die in of vlakbij de tumor liggen, zoals bloedvaten, urinewegen, galwegen en zenuwen, kunnen hierdoor beschadigen, wat kan leiden tot ernstige complicaties. Een tweede nadeel van thermische ablatie is de grotere kans op onvolledige tumordestructie bij laesies nabij grote bloedvaten door het zogenaamde ‘heatsink’-effect: het koelend effect van het stromende bloed op het omliggende weefsel, waardoor warmteverlies optreedt tijdens de ablatie en het tumorweefsel onvoldoende verhit wordt [1].
Onlangs is een nieuwe ablatietechniek geïntroduceerd die bovengenoemde tekortkomingen – voornamelijk theoretisch – omzeilt: irreversibele elektroporatie (IRE). Beeldgestuurd, met behulp van CT of echografie, worden elektroden in en rondom de tumor geplaatst waarna het tumorweefsel aan meerdere korte stroomstoten van zeer hoog voltage wordt blootgesteld. Hierdoor wordt de bestaande membraanpotentiaal van de cel abrupt verstoord en ontstaan er kleine openingen (nano-poriën) in het celmembraan, waarna de cel in apoptose gaat [1]. De extracellulaire matrix, waaraan verschillende (kwetsbare) structuren zoals bloedvaten, galwegen en zenuwen hun stevigheid en vorm ontlenen, blijft hierbij relatief gespaard.
Niet-resectabele tumoren die vanwege hun ligging nabij deze kwetsbare structuren eveneens niet in aanmerking komen voor thermische ablatie kunnen om bovengenoemde reden mogelijk wel veilig met IRE worden behandeld. Aangezien het werkingsmechanisme berust op elektrische energie is er bovendien geen sprake van het ‘heatsink’-effect. Dit suggereert een effectievere ablatie voor tumoren in de nabijheid van grote vaten [2]. Desalniettemin leidt de toepassing van IRE onvermijdelijk tot secundaire Joule verwarming [3]. Voltage, interelektrode afstand, actieve tiplengte en elektrodenconfiguratie blijken allen een significant effect te hebben op de temperatuurontwikkeling gedurende IRE. Hier dient elke arts rekening mee te houden bij het plannen en uitvoeren van de procedure. Toch is het niet ondenkbaar dat het thermische element een synergistisch effect kan hebben op de doeltreffendheid van de behandeling.
Irreversibele elektroporatie: de techniek
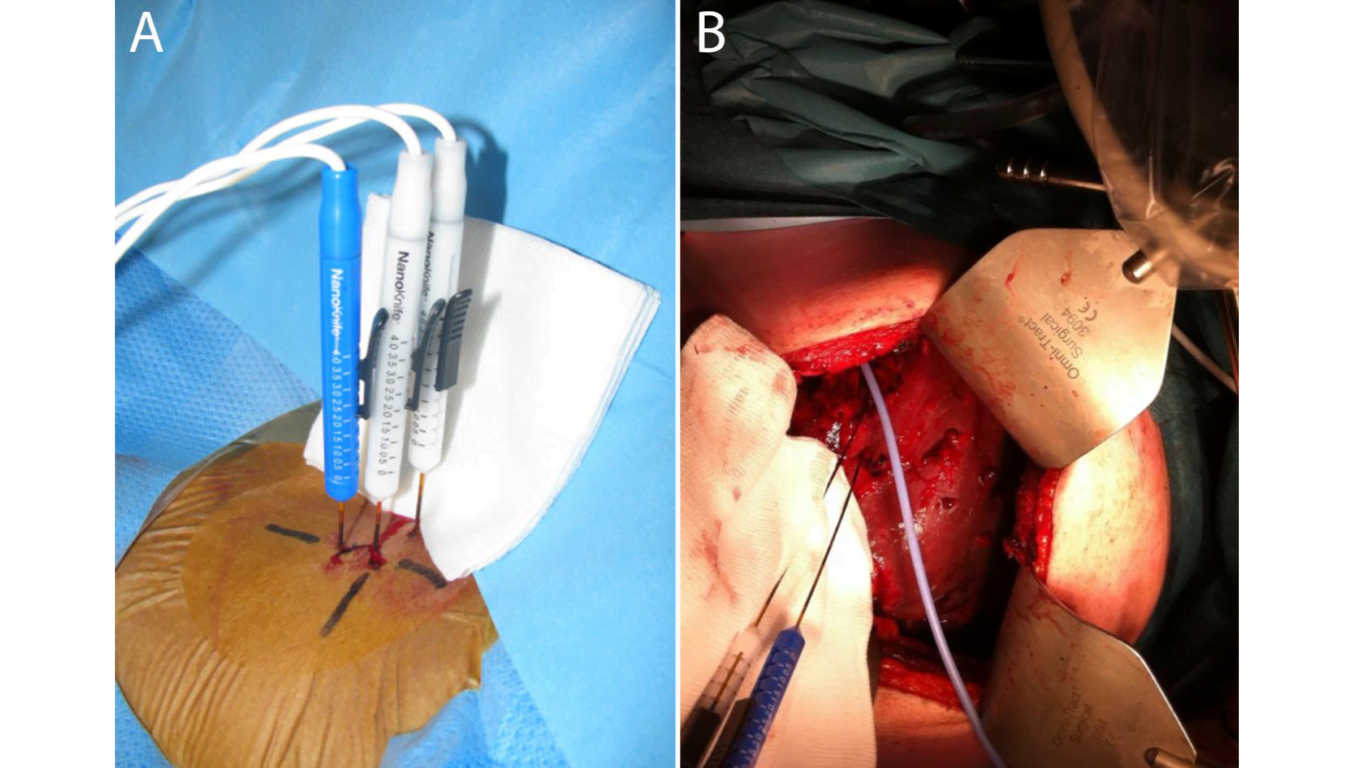
IRE kan zowel percutaan als laparotomisch uitgevoerd worden onder algehele narcose en met volledige spierverslapping (figuur 1). Eerst worden met behulp van echografie of CT de exacte tumorafmetingen vastgesteld waarna de grootte van de gewenste ablatiezone, het aantal en de precieze positie van de elektroden (dunne naalden) bepaald wordt. Twee tot zes elektroden worden vervolgens echo- of CT-geleid gepositioneerd met een onderlinge afstand van 1,5-2,0 cm. De moeilijkheidsgraad voor het plaatsen van de elektroden is vergelijkbaar met die van thermische ablatie maar omdat meerdere naalden parallel aan elkaar geplaatst moeten worden (i.t.t. één naald bij thermische ablatie), vereist het enige oefening.
Wanneer de elektroden juist gepositioneerd zijn worden per elektrodenpaar 90 korte pulsen (90 μs) van 2500-3000 Volt gegeven met idealiter een stroomsterkte van 20-40 Ampère. Als hieraan niet wordt voldaan, worden de elektrische parameters aangepast. De ablatie kan real-time vervolgd worden met echografie; er is direct een hypo-echogene zone zichtbaar, waarvan is bewezen dat deze goed overeenkomt met de uiteindelijke histologische ablatiezone [4]. Wanneer deze zone niet de gehele tumor inclusief een tumorvrije marge omvat, worden de elektroden gerepositioneerd om alsnog al het tumorweefsel te vernietigen.
Voor een interventieradioloog die ruime ervaring heeft met conventionele tumorablatietechnieken zijn enkele IRE-procedures onder supervisie voldoende om de techniek zelfstandig uit te kunnen voeren.
Irreversibele elektroporatie: de indicaties
Hoewel IRE zowel door de FDA als CE goedgekeurd en geregistreerd is voor de ablatie van solide tumoren, bestaat er op dit moment nog geen specifieke indicatie. Het betreft aldus een experimentele behandeling die bij voorkeur uitgevoerd wordt in studieverband en waarvan de indicatie in een multidisciplinair overleg gesteld dient te worden. Desalniettemin krijgt IRE steeds meer aandacht als behandeloptie voor inoperabele pancreas- en levertumoren. Een aanzienlijk deel van de patiënten komt echter niet in aanmerking voor de behandeling vanwege de aanwezigheid van een metalen stent ten behoeve van palliatieve galwegdrainage. Tot nu toe wordt een metalen stent als absolute contra-indicatie beschouwd vanwege het potentiële risico van directe metaalverhitting.
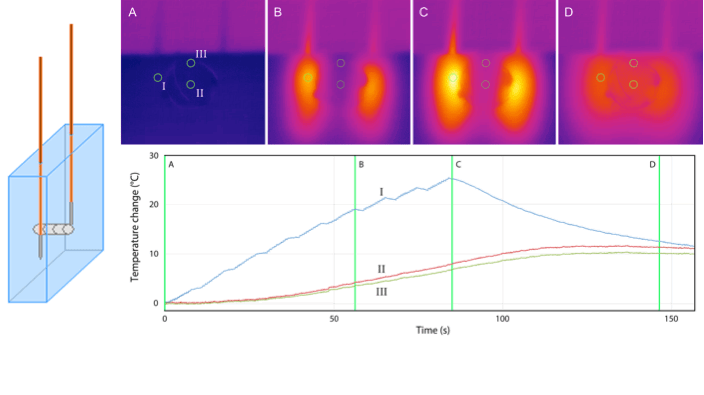
Samen met het AMC onderzocht het onderzoeksteam van het VUmc het effect van een metalen stent op de temperatuurverdeling tijdens IRE. Zowel in een homogeen weefselmodel (polyacrylamidegel) als in een varkenslever werd IRE met en zonder metalen stent uitgevoerd, waarbij 90 en 270 pulsen toegediend werden (15-35 Ampère; 1,5 cm actieve tiplengte; 1,5 cm interelektrode afstand; 1000 – 1500 V/cm; 90 pulsen/minuut). Concluderend vonden zij dat de aanwezigheid van een metalen stent niet leidt tot een noemenswaardige temperatuurverhoging van het metaal of het omliggende weefsel, maar wel resulteert in een hogere temperatuur rond de elektroden met achterblijvend vitaal tumorweefsel rondom de stent. Deze resultaten pleiten inderdaad voor het verwijderen van de stent voorafgaand aan een IRE procedure (resultaten zullen binnenkort worden gepubliceerd) (figuur 2).
Pancreastumoren
Het pancreascarcinoom heeft de hoogste kankergerelateerde sterfte van alle veelvoorkomende kankersoorten: 92% van de patiënten overlijdt binnen 5 jaar vanaf de diagnose en 75% zelfs in het eerste jaar [5]. De prognose is nauwelijks verbeterd in de afgelopen 40 jaar. Chirurgische resectie biedt de beste kans op een langere overleving, maar slechts 15% van alle patiënten komt hiervoor in aanmerking [6]. Bij patiënten met locally advanced pancreatic carcinoma (LAPC, AJCC stadium III) is de tumor uitgebreid rondom essentiële mesenteriale bloedvaten waardoor chirurgische verwijdering niet mogelijk is. Op dit moment is de enige behandeloptie voor patiënten met niet-resectabel pancreascarcinoom chemo- en/of radiotherapie, echter blijft de prognose slecht met een mediane overleving van 6-11 maanden [7]. Voor patiënten met lokaal gevorderde ziekte heeft FOLFIRINOX (5-FU, leucovorine, irinotecan and oxaliplatin) de meest uitgesproken overlevingswinst tot nu toe laten zien (11,7 maanden versus 6,8 maanden) [8]. De combinatie nab-paclitaxel (albumine-gebonden paclitaxel) plus gemcitabine lijkt, ten opzichte van gemcitabine monotherapie, een overlevingsvoordeel te bieden aan patiënten met gemetastaseerde ziekte (8,5 maanden versus 6,7 maanden) [9]. Daarnaast leidt een innovatieve vorm van bestraling, de stereotactische ablatieve radiotherapie (SABR) mogelijk ook tot verbeterde lokale tumorcontrole ten opzichte van de conventionele radiotherapie, waarbij bovendien minder randschade optreedt.
De afgelopen jaren is er veel aandacht geweest voor de thermische ablatie van pancreastumoren met RFA of MWA. De eerste studies wezen echter uit dat er een aanzienlijk risico bestaat op beschadiging van omliggende vitale structuren met een hoge morbiditeit en mortaliteit als gevolg [10]. Of een focale (incomplete) RFA leidt tot een systemische immuunreactie en zodoende tot overlevingswinst ten opzichte van chemotherapie alleen moet blijken uit de recent in Nederland geopende PELICAN-studie (chemotherapie versus chemotherapie plus RFA).
Verscheidene studies ondersteunen de veiligheid en uitvoerbaarheid van IRE bij patiënten met LAPC met een aanvaardbare morbiditeit [11–15]. IRE-gerelateerde complicaties waren duodenum-, pancreas- en gallekage en trombose van de vena portae (laparotomisch 14%, percutaan 9%). Bij patiënten met LAPC werd een langere overleving gesuggereerd na open IRE in combinatie met chemoradiatie (n=54) dan na chemoradiatie alleen (n=85) (11 maanden versus 20 maanden), bij verder grotendeels overeenkomende patiënt- en tumorkarakteristieken tussen de twee groepen. Daarnaast werd een significante vermindering van pijn gezien 10. Percutane IRE bij LAPC resulteerde eveneens in goede lokale tumorcontrole (n=14) [13].
Het VUmc voerde recent de PANFIRE pilotstudie uit: een fase-I-studie naar de veiligheid en effectiviteit van percutane IRE voor LAPC. De inclusie van de PANFIRE studie is inmiddels voltooid. Hoewel er nog geen langetermijnfollow-up is, zijn de voorlopige resultaten veelbelovend. Dit heeft geleid tot de ontwikkeling van een nieuwe, internationale studie: de CROSSFIRE-studie. Deze fase-III-studie is geïnitieerd om meer inzicht te geven over de effectiviteit van IRE in combinatie met FOLFIRINOX, ten opzichte van SABR met FOLFIRINOX. Het onderzoeksteam verwacht dat de combinatie van chemotherapie plus lokale tumordestructie met IRE zal leiden tot een verbeterde overleving, symptoomverlichting en minder bijwerkingen van de behandeling ten opzichte van SABR.
Levertumoren
Primaire en secundaire levertumoren zijn een toenemend wereldwijd gezondheidsprobleem. Hepatocellulair carcinoom (HCC) is een snelgroeiende oorzaak van kanker-gerelateerde mortaliteit door de toenemende incidentie en de slechte prognose [16]. Daarnaast is de lever een veelvoorkomende plaats voor metastasen, in het bijzonder voor het colorectale carcinoom [17]. Voor bovengenoemde levertumoren biedt chirurgische resectie de beste kans op overleving [16-17]. Wanneer operatieve verwijdering niet mogelijk is, bijvoorbeeld omdat resectie van alle metastasen resulteert in te weinig restlever of omdat de patiënt vanwege uitgebreide comorbiditeit of hoge leeftijd niet in aanmerking komt voor een grote buikoperatie, is thermische ablatie met RFA of MWA vaak een goed alternatief.
Eventuele lokale recidieven kunnen relatief eenvoudig (percutaan) opnieuw behandeld worden. Echter, ook voor de lever geldt dat niet alle tumoren operabel of thermisch-ableerbaar zijn vanwege hun centrale ligging. Tot voor kort was in dit geval (palliatieve) chemotherapie de standaardbehandeling en was genezing dus niet meer realistisch. Met de komst van IRE komt hier hopelijk verandering in. Inmiddels zijn er verschillende studies verschenen over de effectiviteit van IRE voor primaire en secundaire levertumoren [2,18–21], waarbij na een follow-up variërend van 3-18 maanden een volledige remissie in 55-93% van de tumoren werd bereikt. Dit percentage was hoger voor tumoren
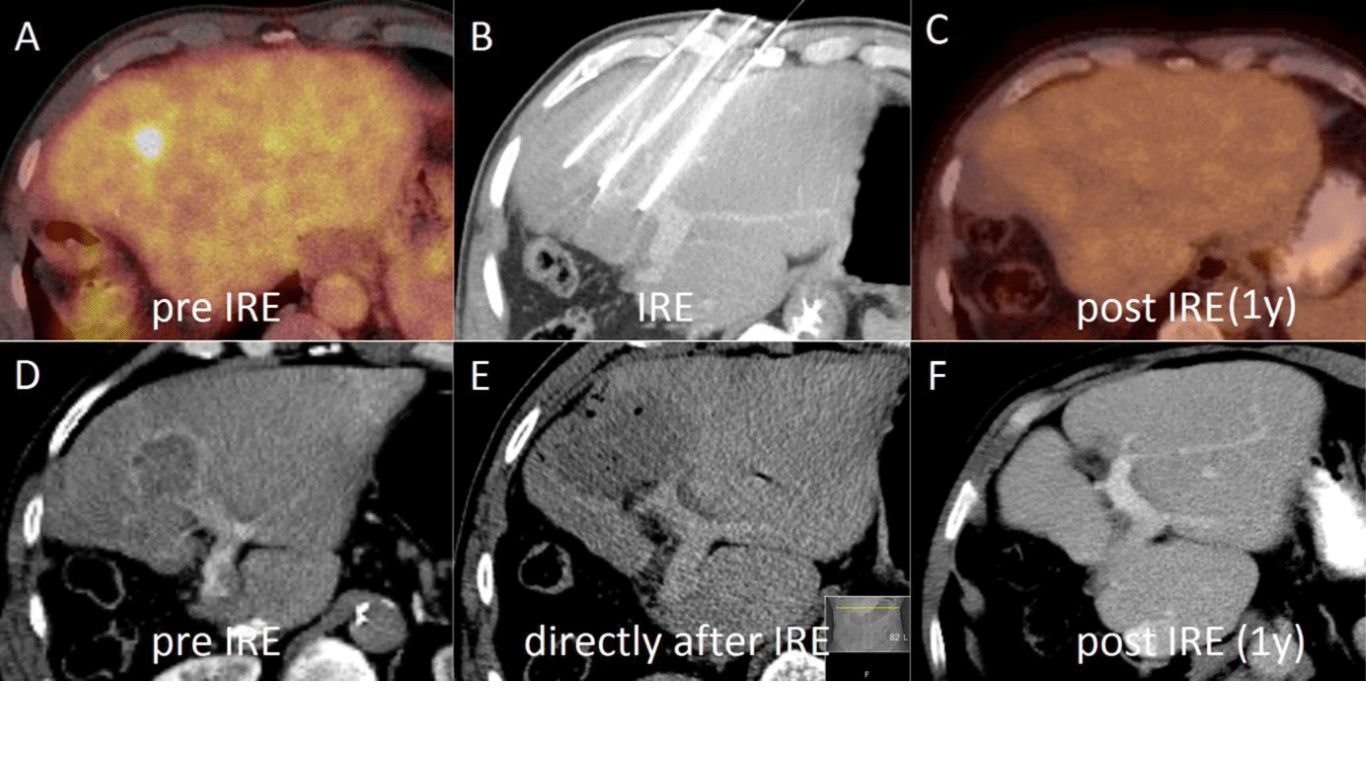
Perihilaire galwegtumoren (Klatskintumoren)
Het cholangiocarcinoom is een zeldzame tumor met een incidentie van 1,2/100.000 en een slechte prognose (5-jaarsoverleving 5-10%). In tweederde van de gevallen zijn patiënten ouder dan 65 jaar. Ongeveer 25% van alle cholangiocarcinomen zijn perihilairgelegen (Klatskintumoren). Voor deze tumoren is resectie de enige kans op langdurige overleving (5-jaarsoverleving 13-40%). Omdat deze tumor pas laat symptomen veroorzaakt zijn ze tijdens presentatie meestal niet meer geschikt voor chirurgische resectie of levertransplantatie. De prognose is slecht, met een mediane overleving van minder dan 6 maanden. Met een combinatie van gemcitabine en cisplatinum kan een overlevingswinst van enkele maanden behaald worden bij locally advanced of gemetastaseerde tumoren [22,23]. Een jaar geleden is in het VUmc voor het eerst in de wereld een patiënt met een locally advanced perihilair galwegcarcinoom behandeld met IRE en vooralsnog zijn er geen aanwijzingen voor tumorrecidief [24]. Er wordt op dit moment gewerkt aan een gezamenlijke fase-1-studie (ALPACA-trial) van het AMC en het VUmc, waarbij 10 patiënten met niet-resectabele Klatskintumoren percutaan behandeld worden met IRE en 10 patiënten met borderline resectabele tumoren open IRE zullen krijgen, wanneer de tumor peroperatief niet te verwijderen blijkt.
Kleinebekkentumoren
Lokale recidieven of metastasen van tumoren in het kleine bekken zijn vanwege hun anatomisch lastige ligging, in een bovendien vaak eerder bestraald gebied, vaak zeer moeilijk te behandelen. Vanwege ingroei in of compressie op de sacrale plexus kunnen deze tumoren vaak tot invaliderende pijnklachten en zenuwuitval leiden. In het VUmc zijn reeds 5 patiënten met (relatief grote) tumoren in het kleine bekken behandeld met IRE, waarvan 3 in het kader van palliatie. Hoewel de zenuwen in theorie niet of nauwelijks aangetast zouden moeten worden door IRE, blijkt dat zenuwen wel degelijk tijdelijk en soms permanent kunnen uitvallen. Hier staat tegenover dat in een aantal patiënten langdurige lokale controle werd bereikt.
Prostaattumoren
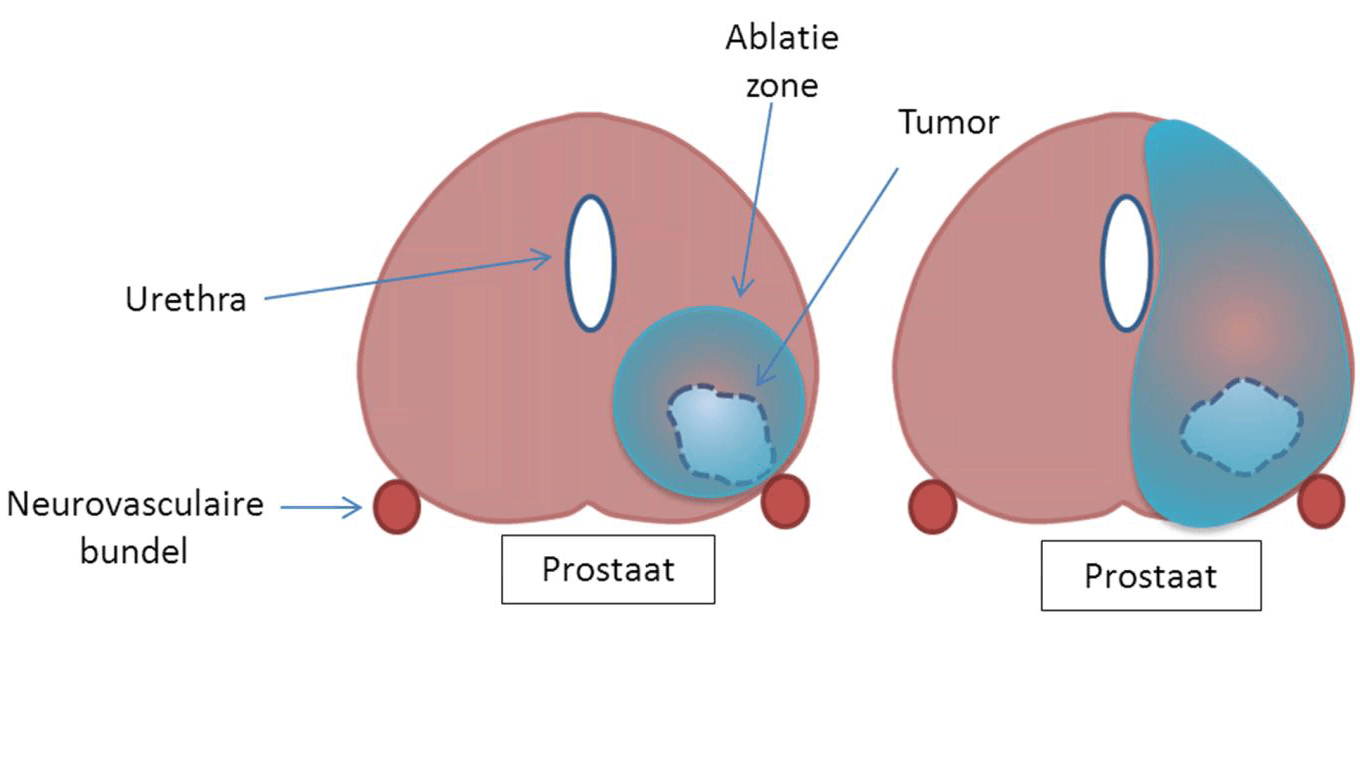
Het prostaatcarcinoom is de meest voorkomende kanker bij mannen in de Westerse wereld [5]. De diagnose wordt door toename van PSA-controle, verbeterde beeldvormende technieken en verhoogde publieke ‘awareness’ in een steeds vroeger stadium gesteld, waardoor de incidentie van het gelokaliseerde prostaatcarcinoom de afgelopen jaren sterk gestegen is [25]. Voor deze gelokaliseerde tumoren, met een laag- of matig-risicoprofiel, is focale therapie een nieuwe experimentele behandelingsbenadering. Focale therapie richt zich specifiek op het behandelen van de prostaattumor zelf in plaats van op de gehele prostaat, zoals bij standaardbehandelingen als radicale prostatectomie of radiotherapie. Door het toepassen van een focale benadering is de kans op schade aan de urethra en de neurovasculaire bundels lager dan bij de conventionele technieken, waardoor bijwerkingen als incontinentie en impotentie minder voorkomen [26]. Minimaal invasieve ablatietechnieken als cryotherapie, lasertherapie, high-intensity focused ultrasound (HIFU) en IRE worden gebruikt als focale therapie. De nog spaarzame literatuur toont aan dat IRE voor prostaatkanker een veilig uit te voeren behandeling is, waarbij geen ernstige complicaties voorkwamen [27–29]. Valerio et al. [29] beschreef in zijn studie (34 patiënten) de meest voorkomende bijwerkingen: dysurie (18%, n=6), debris en/of hematurie (15%, n=5) en urineweginfecties (15%, n=5). Potentie werd behouden in 95% en 100% van de patiënten was continent na follow-up van gemiddeld 6 maanden. Vier patiënten ondergingen een secundaire behandeling d.m.v. IRE, HIFU of radicale prostatectomie.
De – nog niet gepubliceerde – resultaten van de fase 1-2 IRE-studie uitgevoerd in het AMC Amsterdam bevestigen dat IRE-behandeling in prostaatkanker veilig is. De studie, waarbij zestien patiënten zijn behandeld met IRE gevolgd door een radicale prostatectomie een maand later, toont aan dat de patiënten weinig tot geen complicaties of pijn ondervonden na IRE. Bijwerkingen als plas- en potentieklachten waren van tijdelijke aard en histopathologische analyse van het prostaatweefsel ter plaatse van de focale behandeling toont volledige fibrotisering en necrotisering van het weefsel zonder maligne cellen binnen het behandelde gebied.
Dit goede resultaat heeft geleid tot de ontwikkeling van een gerandomiseerde multicenterstudie (RCT) waarbij de functionele en oncologische uitkomsten van specifiek tumorgerichte IRE-behandeling wordt vergeleken met een uitgebreidere IRE-behandeling (hemi-ablatie) van de prostaat (zie figuur 4). De inclusiecriteria zijn T1c-T2a prostaattumoren met aangrenzende positieve biopten bij systematische transperineale prostaatbioptie, Gleason 6 of 7, PSA < 15 ng/mL en een levensverwachting van meer dan 10 jaar. De studie is op dit moment open voor inclusie.
Overige indicaties
IRE lijkt niet effectief bij longmaligniteiten, waarschijnlijk doordat het elektroporatie-effect beperkt is door de slechte geleiding van lucht [30]. De veiligheid van IRE in de nier is redelijk en de voorlopige resultaten over de effectiviteit lijken veelbelovend. Langetermijnresultaten ontbreken vooralsnog en meer onderzoek is nodig om de meerwaarde ten opzichte van thermische technieken vast te stellen [30].
Alhoewel patiënten in dit stadium bij voorkeur in de setting van prospectieve studies behandeld worden, is dit voor een groot aantal zeldzame tumoren of tumoruitingen niet realistisch. Deze patiënten kunnen binnen het VUmc na goedkeuring door het multidisciplinaire team en na het tekenen van een informed consentformulier toch in aanmerking komen voor IRE.
Zo is in het VUmc een patiënt met een lokaal recidief van schildkliercarcinoom succesvol behandeld met IRE. Na twee dagen werd hij in goede conditie, zonder complicaties, ontslagen uit het ziekenhuis. Follow-up van zeven maanden later liet geen aanwijzingen zien voor recidief [32].
Voor alle patiënten die binnen en buiten studieverband worden behandeld met IRE worden de gegevens opgeslagen in een database (prospectieve IRE-registry)
Conclusie
Irreversibele elektroporatie (IRE) is een nieuwe, beeldgestuurde tumorablatietechniek waarbij het werkingsmechanisme berust op elektrische energie. Hoewel de langetermijnresultaten nog onbekend zijn lijkt de toekomst van IRE veelbelovend voor tumoren die gelegen zijn naast kwetsbare structuren zoals vaten, galwegen, urinewegen en zenuwen.
Aanwijzingen voor de praktijk
- Thermische ablatietechnieken kennen een hoge morbiditeit en mortaliteit voor tumoren in de nabijheid van vitale structuren zoals galwegen, bloedvaten, urinewegen en darmen.
- Thermische ablatietechnieken kennen een relatief groot risico op incomplete ablatie bij perivasculaire tumoren door het zogenaamde ‘heat-sink’-effect.
- Irreversibele elektroporatie (IRE) is een veelbelovende ablatietechniek voor tumoren nabij kwetsbare structuren die niet in aanmerking komen voor chirurgie of conventionele ablatietechnieken.
- Omdat het primaire werkingsmechanisme van IRE niet gebaseerd is op warmte, speelt het heat-sink effect waarschijnlijk niet of nauwelijks een rol.
- Voor lever- en prostaattumoren is IRE bewezen veilig en lokaal effectief; bij IRE van tumoren in het kleine bekken kan permanente zenuwuitval optreden; bij het pancreascarcinoom zijn de risico’s aanvaardbaar en de resultaten veelbelovend. Langetermijnresultaten met overlevingsgetallen ontbreken echter nog grotendeels.
Referenties
[1] EW Lee et al, Irreversible electroporation: a novel image-guided cancer therapy. Gut Liver. 2010 Sep;4 Suppl 1(September):S99–104.
[2] TP Kingham et al, Ablation of perivascular hepatic malignant tumors with irreversible electroporation. J Am Coll Surg. 2012 Sep;215(3):379–87.
[3] M Faroja et al, Irreversible electroporation ablation: is all the damage nonthermal? Radiology. 2013 Feb;266(2):462–70.
[4] HJ Scheffer et al, Ablation of colorectal liver metastases by irreversible electroporation: results of the COLDFIRE-I ablate-and-resect study. Eur Radiol. 2014 Oct;24(10):2467–75.
[5] RL Siegel et al, Cancer Statistics, 2015. CA Cancer J Clin. 2015;65(1):5–29.
[6] KY Bilimoria et al, Validation of the 6th edition AJCC Pancreatic Cancer Staging System: report from the National Cancer Database. Cancer. 2007 Aug 15;110(4):738–44.
[7] F Huguet et al, Chemoradiotherapy in the management of locally advanced pancreatic carcinoma: a qualitative systematic review. J Clin Oncol. 2009 May 1;27(13):2269–77.
[8] JE Faris et al, FOLFIRINOX in locally advanced pancreatic cancer: the Massachusetts General Hospital Cancer Center experience. Oncologist. 2013 Jan;18(5):543–8.
[9] DD Von Hoff et al, Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med. 2013 Oct 31;369(18):1691–703.
[10] R Girelli et al, Feasibility and safety of radiofrequency ablation for locally advanced pancreatic cancer. Br J Surg. 2010 Feb;97(2):220–5.
[11] S Paiella et al, Safety and Feasibility of Irreversible Electroporation (IRE) in Patients with Locally Advanced Pancreatic Cancer: Results of a Prospective Study. Dig Surg. 2015 Feb 28;90–7.
[12] RCG Martin et al, Irreversible electroporation in locally advanced pancreatic cancer: potential improved overall survival. Ann Surg Oncol. 2013 Dec;20 Suppl 3:S443–9.
[13] RCG Martin et al, Irreversible electroporation therapy in the management of locally advanced pancreatic adenocarcinoma. J Am Coll Surg. 2012 Sep;215(3):361–9.
[14] P Philips et al, Irreversible electroporation ablation (IRE) of unresectable soft tissue tumors: learning curve evaluation in the first 150 patients treated. PLoS One. 2013 Jan;8(11):e76260.
[15] G Narayanan et al, Percutaneous irreversible electroporation for downstaging and control of unresectable pancreatic adenocarcinoma. J Vasc Interv Radiol. 2012 Dec;23(12):1613–21.
[16] AB Benson et al, NCCN clinical practice guidelines in oncology: hepatobiliary cancers. J Natl Compr Canc Netw. 2009 Apr;7(4):350–91.
[17] AB Benson et al, Metastatic colon cancer, version 3.2013: featured updates to the NCCN Guidelines. J Natl Compr Canc Netw. 2013 Feb;11(2):141–52; quiz 152.
[18] R Cannon et al, Safety and early efficacy of irreversible electroporation for hepatic tumors in proximity to vital structures. J Surg Oncol. 2013 Apr 1;107(5):544–9.
[19] W Cheung et al, Irreversible electroporation for unresectable hepatocellular carcinoma: initial experience and review of safety and outcomes. Technol Cancer Res Treat. 2013 Jun;12(3):233–41.
[20] MT Silk et al, Percutaneous ablation of peribiliary tumors with irreversible electroporation. J Vasc Interv Radiol. 2014 Jan;25(1):112–8.
[21] KR Thomson et al, Investigation of the safety of irreversible electroporation in humans. J Vasc Interv Radiol. 2011 May;22(5):611–21.
[22] I Popescu et al, Curative-intent surgery for hilar cholangiocarcinoma: prognostic factors for clinical decision making. Langenbecks Arch Surg. 2014 Aug;399(6):693–705.
[23] YA Ghouri et al, Cancer review: Cholangiocarcinoma. J Carcinog. Medknow Publications and Media Pvt. Ltd.; 2015 Jan 1;14(1):1.
[24] MCAM Melenhorst et al, Percutaneous Irreversible Electroporation of Unresectable Hilar Cholangiocarcinoma (Klatskin Tumor): A Case Report. Cardiovasc Intervent Radiol. 2015 May 21;
[25] TJ Polascik et al, Pathologic stage T2a and T2b prostate cancer in the recent prostate-specific antigen era: Implications for unilateral ablative therapy. Prostate. 2008;68(13):1380–6.
[26] M Valerio et al, The Role of Focal Therapy in the Management of Localised Prostate Cancer: A Systematic Review. Eur Urol. European Association of Urology; 2013 Jun;44(0):1–20.
[27] G Onik et al, First Patient Experience Focal Therapy of Prostate Cancer. Irreversible Electroporation. Series in . Springer Berlin Heidelberg; 2010. p. 235–47.
[28] RE Neal et al, In vivo characterization and numerical simulation of prostate properties for non-thermal irreversible electroporation ablation. Prostate. 2014 Jan;468:458–68.
[29] M Valerio et al, Initial assessment of safety and clinical feasibility of irreversible electroporation in the focal treatment of prostate cancer. Prostate Cancer Prostatic Dis. 2014 Sep;(May):1–5.
[30] J Ricke et al, Irreversible electroporation (IRE) fails to demonstrate efficacy in a prospective multicenter phase II trial on lung malignancies: the ALICE trial. Cardiovasc Intervent Radiol. 2015 Apr;38(2):401–8.
[31] M Pech et al, Irreversible electroporation of renal cell carcinoma: a first-in-man phase I clinical study. Cardiovasc Intervent Radiol. 2011 Feb;34(1):132–8.
[32] MR Meijerink et al, Percutaneous irreversible electroporation (IRE) for recurrent thyroid cancer – a case report. J Vasc Interv Radiol. 2015;In press.