Te vroeggeboren kinderen hebben een grote kans op respiratoir falen door 1) een onrijpe ademhalingsregulatie wat kan resulteren in adempauzes (apneus), welke weer kunnen leiden tot daling in de zuurstofspanning en hartslag; 2) een beperkte longfunctie wat leidt tot een verhoogde ademarbeid. Adequate registratie van de ademhaling en hartslag is daarom essentieel op een Neonatale Intensive Care (NICU). De afgelopen jaren hebben wij op de NICU van het Amsterdam UMC onderzoek gedaan naar hoe de ademhaling beter kan worden geregistreerd met behulp van het meten van de elektrische activiteit van het diafragma met plakelektroden (dEMG).
Regulatie van de ademhaling
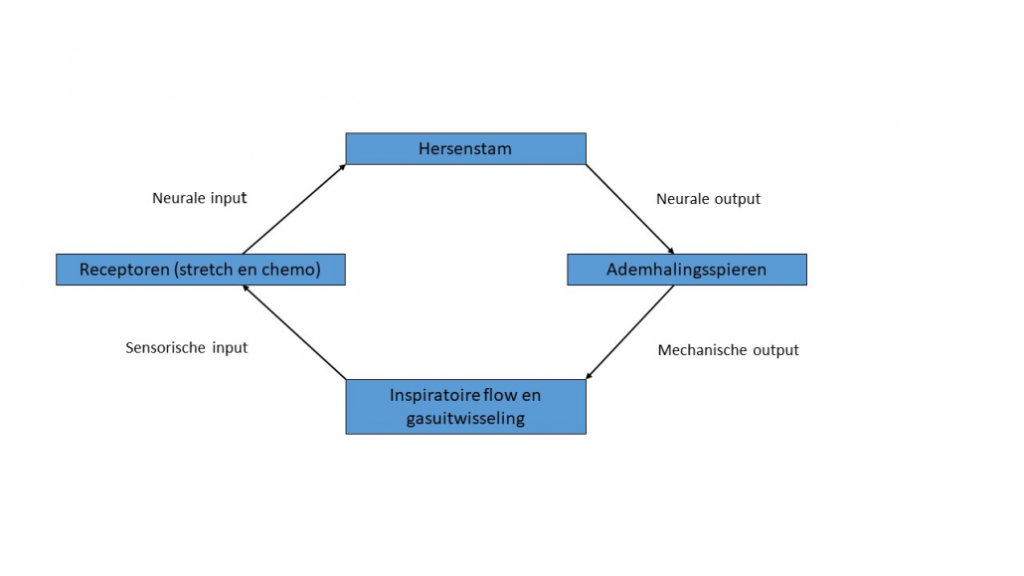
Zoals met veel fysiologische processen, wordt de ademhaling gereguleerd door een feedback systeem. Door contractie van het diafragma ontstaat een inspiratoire flow. De ingeademde lucht komt in de alveoli terecht waarbij het meedoet in de gaswisseling. Receptoren kunnen mechanische veranderingen (zoals longinflatie) en chemische parameters in het bloed (pO2 en pCO2) detecteren. Deze informatie wordt verstuurd naar het ademhalingscentrum in de hersenstam, welke weer informatie doorstuurt naar de ademhalingsspieren (figuur 1). Deze complexe regulatie van de ademhaling is nog niet volledig functioneel bij te vroeggeboren kinderen. Dit resulteert in apneus welke kunnen worden geclassificeerd in centraal (onderbreking van de inspiratoire flow door afwezigheid van ademhalingsbewegingen), obstructief (onderbreking van de flow door samenvallen van de bovenste luchtwegen met daarbij verhoogde ademarbeid) of een gecombineerd beeld van centraal en obstructief. De apneus kunnen leiden tot dalingen in hartslag en zuurstofsaturatie, die op de langere termijn schadelijk kunnen zijn. Behandeling van apneus hangt af van het soort en bestaat uit behandeling met medicijnen die de ademhaling stimuleren (coffeïne en doxapram) of ondersteuning van de ademhaling zoals nasal continuous positive airway pressure (nCPAP). Om adequate therapie te starten is het dus belangrijk om de ademhalingsfrequentie, ademhalingspatroon en de hartslag van te vroeggeboren kinderen goed te registeren.
Cardiorespiratoire monitoring
Accurate monitoring van ademhaling en hartslag bij te vroeggeboren kinderen houdt in dat het de ademhaling kan kwantificeren en kwalificeren en veranderingen in de hartfrequentie kan registeren. Op dit moment worden het hartritme (elektrocardiogram (ECG)) en de chest impedance (CI) als techniek gebruikt als cardiorespiratoire monitoring. Met behulp van CI wordt een ademhalingscurve (o.b.v. veranderingen in impedantie door luchtverplaatsing in de borstkas) verkregen, waaruit een ademhalingsfrequentie kan worden berekend. Deze techniek heeft echter beperkingen waardoor er minder of onjuiste detectie van apneus optreedt. Ademhaling op zich kan vaak wel gedetecteerd worden, maar hoe diep, sterk of regelmatig de patiënt ademt is niet te zeggen (de kwalificatie van de ademhaling). Om deze tekortkomingen te overbruggen zijn wij gaan onderzoeken of het meten van de elektrische activiteit van de belangrijkste ademhalingsspier, het diafragma, een alternatief zou kunnen zijn voor cardiorespiratoire monitoring op de NICU.
Elektromyografie van het diafragma
Het diafragma, ofwel middenrif, is de belangrijkste ademhalingsspier. Als het diafragma samentrekt komt deze naar beneden en gaan de ribben opzij, waardoor er meer ruimte ontstaat in de borstholte en de longen zich kunnen vullen met lucht. Tijdens contractie van het diafragma ontstaat elektrische activiteit door depolarisatie van de spiervezels en deze actiepotentiaal kan door elektroden worden waargenomen als een verandering in voltage over de tijd.
Het meten van de elektrische activiteit van het diafragma kan invasief middels het plaatsen van een katheter in de slokdarm of niet-invasief middels plak elektroden op de huid. Op onze afdeling hebben wij gebruik gemaakt van de laatste techniek, waarbij er twee elektroden worden geplaatst ter hoogte van het diafragma en één op het borstbeen (referentie elektrode). De grootste uitdaging ligt in het bewerken van het verkregen ruwe dEMG-signaal. Ten eerste kan de basislijn van het signaal afwijken (een ‘offset’ hebben) en over tijd variëren (een ‘drift’ hebben), door veranderingen over tijd in het huid-elektrode contact of de eigenschappen van de signaal versterker. Met signaalfiltering kunnen we hiervoor corrigeren.
De interferentie van de hartspier op het dEMG-signaal is echter in de signaalverwerking de grootste uitdaging. Zowel het hart als het diafragma genereren een elektrische activiteit tijdens hun contractie. De signaalsterkte van het hart is echter veel groter dan die van het diafragma. Om deze reden is het detecteren en verwijderen van het QRS-complex uit het ruwe dEMG-signaal de meest essentiële stap om de contracties van het diafragma zichtbaar te maken. Als laatste stap wordt de cumulatieve contractie in beeld gebracht door een lopend gemiddelde van de absolute waarden te berekenen en zo het ademhalingssignaal te construeren (figuur 2). Ten slotte worden uit deze ademhalingscurve nog signaalartefacten als gevolg van bijvoorbeeld de bewegingen van het kind verwijderd.
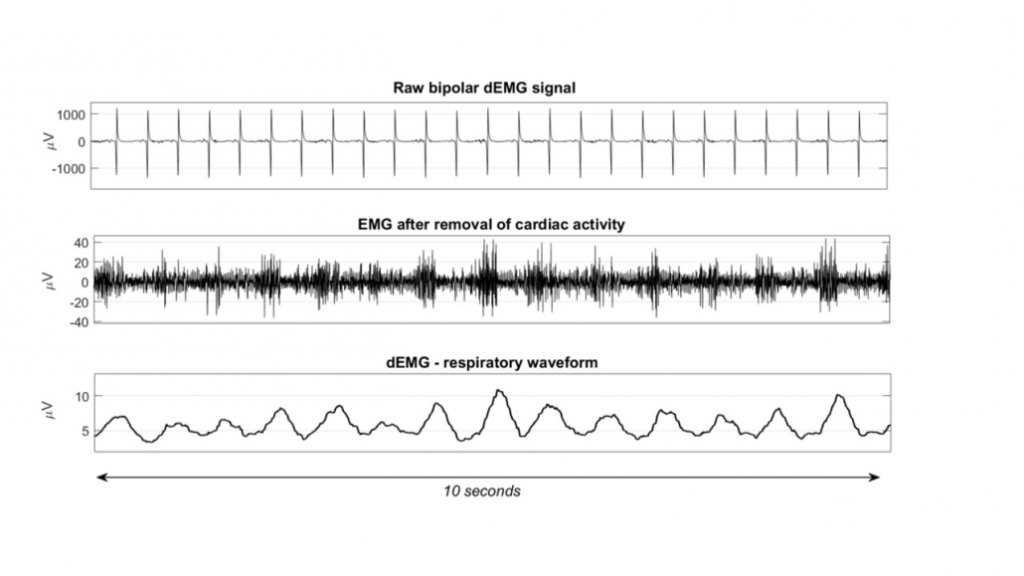
Uit deze verkregen ademhalingscurve kunnen de volgende parameters worden berekend. De piek van het dEMG signaal (dEMGpeak) weerspiegelt de maximale elektrische activiteit van het diafragma. De elektrische activiteit van het diafragma aan het einde van expiratie wordt de tonische activiteit genoemd (dEMGton). De amplitude van het dEMG-signaal wordt berekend door dEMGton af te trekken van de dEMGpeak. De ademhalingsfrequentie van het dEMG-signaal (dEMGrr) kan worden berekend door het aantal pieken per minuut in het dEMG-signaal te bepalen. Om de krachtinspanning van een ademhaling nog verder in kaart te brengen, kan bijvoorbeeld ook naar de oppervlakte onder de curve gekeken worden.
Technische haalbaarheid
Als eerste hebben we de haalbaarheid van dEMG in een NICU-setting aangetoond. De hartfrequentie gemeten met het dEMG komt goed overeen met de hartfrequentie van het ECG-signaal van de CI techniek. Verder is er een significante correlatie tussen de ademhalingsfrequentie gemeten met beide technieken. Ook is gebleken dat de dEMG techniek in staat is om veranderingen in de elektrische activiteit van het diafragma te registreren. Na het toedienen van bijvoorbeeld het medicijn coffeïne werd een significante toename gemeten van dEMGpeak. Ook na het afbouwen van de ademhalingsondersteuning werden er veranderingen gemeten in de elektrische activiteit van het diafragma. Waar de CI techniek moeite heeft met het onderscheid maken tussen de verschillende soorten apneus, kan dEMG beter discrimineren tussen een centrale of obstructieve apneu. Bij een centrale apneu wordt geen activiteit van het diafragma gezien, terwijl bij een obstructieve apneu er toename is te zien van de activiteit van het diafragma. Daarentegen registreert de CI-techniek vaak nog ademhaling tijdens een centrale apneu door cardiale interferentie.
De dEMG techniek is dus in staat om de ademhaling de kwantificeren, het ademhalingspatroon te registeren en de hartfrequentie te monitoren.
De kwalificatie van de ademhaling is onderzocht door de activiteit van het diafragma te vergelijken met invasief gemeten ademarbeid en te onderzoeken of de activiteit van het diafragma voor en na detubatie verschilt bij kinderen die succesvol van de invasieve beademing werden gehaald en kinderen die hierin faalden. Er werd een gemiddelde correlatie gevonden tussen ademarbeid en de elektrische activiteit van het diafragma. De verklaring hiervoor is dat er in een kleine groep is gekeken en de patiënten stabiel waren aan ademhalingsondersteuning. Daarentegen vonden we duidelijke verschillen tussen kinderen die succesvol werden gedetubeerd en de kinderen die hier niet in slaagden. De laatste groep had een significantie hogere activiteit van het diafragma voor detubatie en deze hogere activiteit bleef bestaan na detubatie.
Klinische applicatie
Door het gebruik van dEMG als cardiorespiratoire monitoring bij te vroeggeboren kinderen kan de ademhaling inzichtelijker worden gemaakt ten opzichte van CI. De apneu-detectie kan worden verbeterd waardoor de behandeling van apneus gerichter kan worden. Verder zou kwalificeren van de ademhaling de ademhalingsondersteuning objectiever kunnen worden afgestemd op de behoefte van de patiënt. Dit alles met behoud van registratie van hartfrequentie en ademhalingsfrequentie. Een belangrijke volgende stap is het synchroniseren van de ademhalingsondersteuning met de eigen spontane ademhaling van de patiënt, gemeten met dEMG. Met behulp van de spieractiviteit van het diafragma zou dan de start van een ademhaling gedetecteerd kunnen worden, waarna de ventilator ademhalingsondersteuning kan bieden.
De stap om dEMG als standaard te maken voor registratie van ademhaling en hartslag kan relatief klein zijn. De algoritmes zijn beschikbaar en het vereist niet meer plakelektroden dan de CI-techniek Echter moet de connectie met de huidige bed-side patiënten-monitor nog worden gemaakt en dienen de elektroden op een andere plek te worden gepositioneerd.
Het (automatisch) aanpassen van de ademhalingsondersteuning op de individuele behoefte van de patiënt en het synchroniseren van de ademhalingsondersteuning met de spontane ademhaling van de patiënt vergt meer onderzoek. Bij welke activiteit van het diafragma kan de ademhalingsondersteuning worden afgebouwd of moet deze juist worden opgehoogd? Hoe snel moet de detectie van de spontane ademhaling zijn om het beademingsapparaat goed aan te kunnen sturen? Hiervoor is vervolgonderzoek op dit moment gaande in het Amsterdam UMC.
Conclusie
Met elektromyografie van het diafragma met plak elektrodes kan de ademhaling van te vroeg geboren kinderen worden gekwantificeerd en gekwalificeerd met behoud van een registratie van hartfrequentie. Daarnaast kan het ademhalingspatroon inzichtelijk worden gemaakt. Vervolg onderzoek moet laten zien of de ademhalingsondersteuning met behulp van dEMG kan worden afgestemd op de individuele behoefte van patiënt en of de ademhalingsondersteuning kan worden gesynchroniseerd met de eigen spontane ademhaling van de patiënt, om zo de behandeling effectiever en comfortabeler te maken.
Met dank aan
Het beschreven onderzoek is en wordt uitgevoerd op de NICU van het Amsterdam UMC geleid door prof. dr. Anton van Kaam. Dit artikel is tot stand gekomen door dr. Jeroen Hutten (Kinderarts-Neonatoloog), dr. Ruud van Leuteren (Klinisch Technoloog), drs. Anouk Scholten (Promovendus en Klinisch Technoloog), en dr. ir. Frans de Jongh (Longfysioloog).







