Leeftijdsgerelateerde maculadegeneratie (LMD) is een van de hoofdoorzaken voor gezichtsverlies bij ouderen wereldwijd. Huidig wordt de progressie deze ziekte gedaan door het visueel te vergelijken van twee scans van het oog. Deze visuele vergelijking is subjectief en vatbaar voor fouten. Dit proces kan worden vervangen door middel van deep learning, waardoor de beelden kwantitatief kunnen worden geanalyseerd. In dit artikel wordt het gehele proces praktisch uitgelegd, van het preparen van de data tot het testen van het gemaakte algoritme.
Introductie
Leeftijdsgerelateerde maculadegeneratie (LMD) is een van de hoofdoorzaken voor gezichtsverlies bij ouderen wereldwijd [1]. Naar schatting zullen tegen het einde van dit jaar, 196 miljoen mensen wereldwijd zijn gediagnosticeerd met LMD. Dit aantal zal in in twintig jaar toenemen naar 288 miljoen [2]. Het is een asymtomische ziekte in het vroege stadium, wat betekent dat de patiënt niets merkt aan zijn of haar gezichtsvermogen. In latere stadia van de ziekte is verlies van het centrale gezichtsvermogen mogelijk en uiteindelijk blindheid, indien niet tijdig behandeld [3].
Het macula is een klein gebied op midden van het netvlies. In het netvlies bevinden zich kegelvormige en staafvormige fotoreceptoren die licht omzetten in zenuwsignalen richting de hersenen. Het macula is het gebied wat de meeste kegelvormige fotoreceptoren bevat, wat zorgt voor het scherp zien. In het latere stadium van LMD sterven deze fotoreceptoren af, waardoor mensen hun centrale gezichtsvermogen verliezen [4].
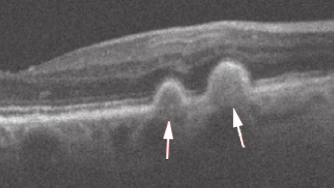
Een van de belangrijkste risicofactoren voor LMD zijn drusen, afzettingen van lipiden en eiwitten die zich ophopen aan de achterkant van het netvlies. Er zijn verschillende drusen, die kunnen worden onderscheiden op basis van hun vorm en locatie binnen de netvlieslagen. Harde drusen zijn gekenmerkt door hun ronde vorm, meestal kleiner dan 63 μm. Waarbij harde drusen, geen tot weinig risico vormen voor het ontwikkelen van LMD [5]. Wegens deze reden is in dit onderzoek de focus gelegd op zachte drusen, die daarentegen een hoge risicofactor vormen voor het ontwikkelen van LMD [5]. Ze worden meestal gekenmerkt door een koepelachtige vorm (≥ 250μm) gelegen tussen het retinal pigment epithelium (RPE) en de binnenste laag van het Bruch’s membraan (BM). Dit zijn de twee lagen gelegen tussen de bloedvaten en de fotoreceptoren . Deze zachte drusen kunnen gaan ontsteken, wat ervoor zorgt dat ontstekingscellen rondom deze laag vasculaire groeifactoren vrijlaten.Hierdoor groeien de bloedvaten door het verzwakte Bruch’s membraan heen, richting de fotoreceptoren. Deze bloedvaten lekken vloeistoffen tussen verschillende lagen in het netvlies wat uiteindelijk de fotoreceptoren onherstelbare schade veroorzaakt. Dit eindstadium wordt ook wel natte maculadegeneratie genoemd.
Wegens deze reden is vroegtijdige detectie en het nauw analyseren van de drusen progressie van groot belang om de ziekte te beheersen. In het vroegtijdige stadium wordt deze beheersing gedaan door middel van beschermende maatregelen, zoals verandering in levensstijl en het toedienen van bepaalde antioxidanten en mineralen. Dit verminderd de kans dat de ziekte verergert [6]. Waarbij in een later stadium door middel van anti-vasculaire endotheliale groeifactor (VEGF) injecties gezichtsverlies kan worden gestabiliseerd.
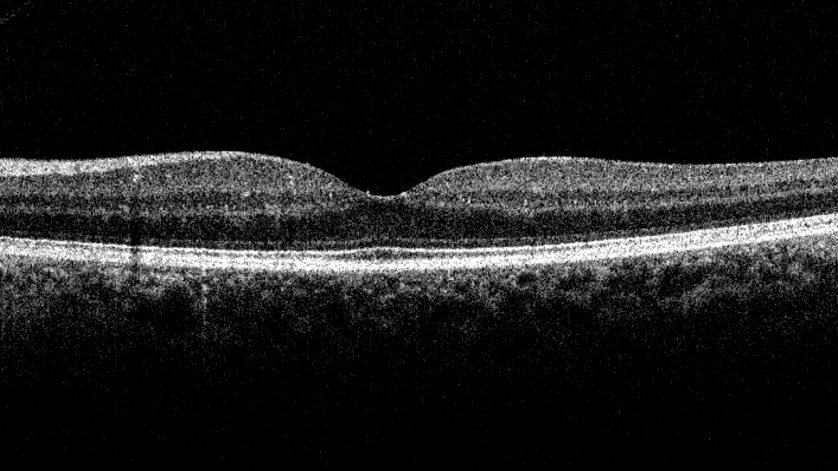
De introductie van optische coherentie tomografie (OCT) binnen oogheelkunde heeft het mogelijk gemaakt om gedetailleerde dwarsdoorsneden-beelden te maken van de netvlieslagen. Deze dwarsdoorsnede beelden worden ook wel B-scanbeelden genoemd. Door middel van deze modaliteit is het mogelijk met micrometer resolutie de drusen in beeld te brengen en de progressie ervan te bewaken. Een voorbeeld van een B-scanbeeld met zachte drusen is te zien in figuur 2 [7].
In het algemeen wordt de progressie van de drusen geanalyseerd door het visueel vergelijken van de B-scanbeelden met eerdere acquisities van dezelfde patiënt. Ondanks dat leveranciers algoritmes leveren voor het registreren van de volumes, blijft deze methode subjectief, tijdrovend en vatbaar voor fouten (BRON). Tevens zijn deze algoritmes gebaseerd op de OCT-apparaten van de leverancier en werken dus niet binnen andere OCT-apparaten. Deze uitkomsten van deze algoritmen zijn vaak gebaseerd op andere kenmerken binnen de scans en hebben geleid tot tegenstrijdige resultaten [8], waardoor de ontwikkeling van een gouden standaardbenadering voor vroege detectie en progressie analyse van zachte drusen wordt uitgesloten [8]. Wegens deze reden is het van groot belang om een algoritme te ontwikkelen wat zachte drusen vroegtijdig kan detecteren en de progressie van drusen kan analyseren binnen meerdere OCT-apparaten van verschillende leveranciers.
Methodologie
Om de drusen progressie analyse te automatiseren is er gebruik gemaakt van artificiële intelligentie, specifiek deep learning. Deep learning is een vorm van artificiële intelligentie waarbij gebruik gemaakt wordt van neurale netwerken. Binnen deze netwerken zijn neuronen aan elkaar verbonden, die elk een calculatie maakt of de neuron moet activeren. Heeft een neuron de waarde bereikt, dan activeert het en geeft het een waarde door aan de volgende neuron in de reeks. Deze methodiek is gebaseerd op het biologische neurale netwerken zoals de hersenen, waarin zenuwcellen activeren als zij genoeg stimuli krijgen.
Dataset
Binnen dit onderzoek is er gebruik gemaakt van een manier van deep learning genaamd “Supervised deep learning”. Dit houdt in dat het netwerk wordt ontwikkeld door middel van handmatig ingetekende annotaties. Deze beelden en annotaties zijn afkomstig vanuit een openbare dataset van Duke University [9]. Binnen deze dataset bevinden zich 15.766 B-scanbeelden van 384 participanten, waarvan 115 gezonde volumes en 269 beginfase LMD volumes. Deze beelden worden opgedeeld in twee partities; een train-partitie en een test-partitie. Waarvoor de train-partitie wordt gebruikt voor het trainen van het model, en de test-partitie voor de evaluatie van het getrainde model.
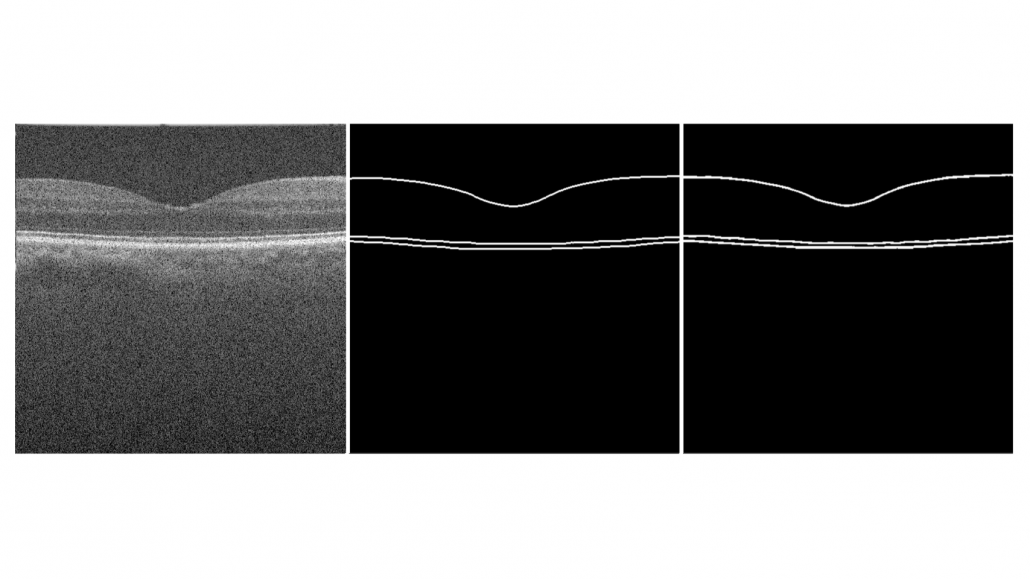
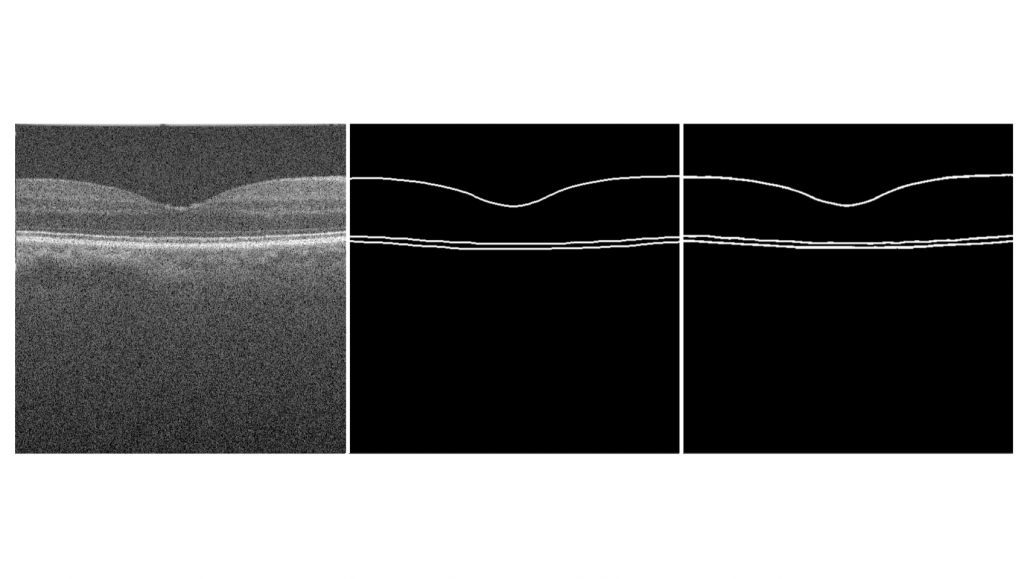
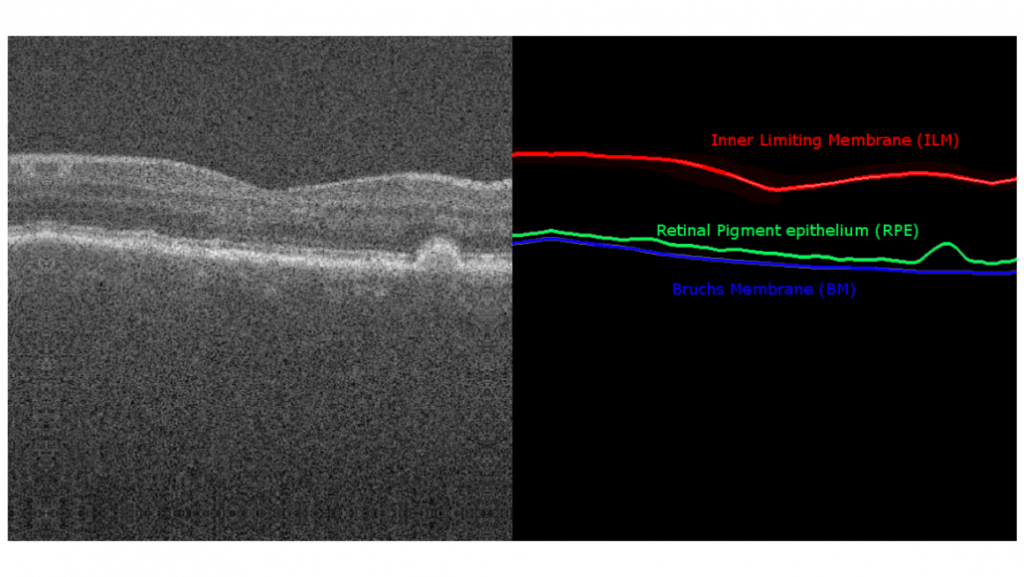
Drie verschillende netvlieslagen zijn uitgetekend binnen deze annotaties, bestaande uit het Inner Limiting Membrane (ILM), Retinal Pigment Epithelium (RPE) en het Bruch’s Membrane (BM). Er is gekozen voor deze annotaties omdat de zachte drusen tussen het RPE en het BM ligt. Hierdoor kunnen we later het oppervlakte tussen deze twee lijnen analyseren. Een voorbeeld van deze B-scanbeelden en annotaties is te zien in figuur 3.
Data augmentatie
Om het netwerk onafhankelijk te maken van enkel één OCT-apparaten, is een grote variatie aan beelden nodig. Echter, er was voor de ontwikkeling maar één dataset beschikbaar die genoeg participanten had. Wegens deze reden hebben we gebruik gemaakt van data augmentatie. Hierbij worden de originele OCT-beelden gemanipuleerd en wordt er een artificieel beeld gecreëerd, ook wel een augmentatie genoemd. Bijvoorbeeld door het horizontaal te spiegelen van het beeld. Zie figuur 4 voor een visualisatie van dit voorbeeld.
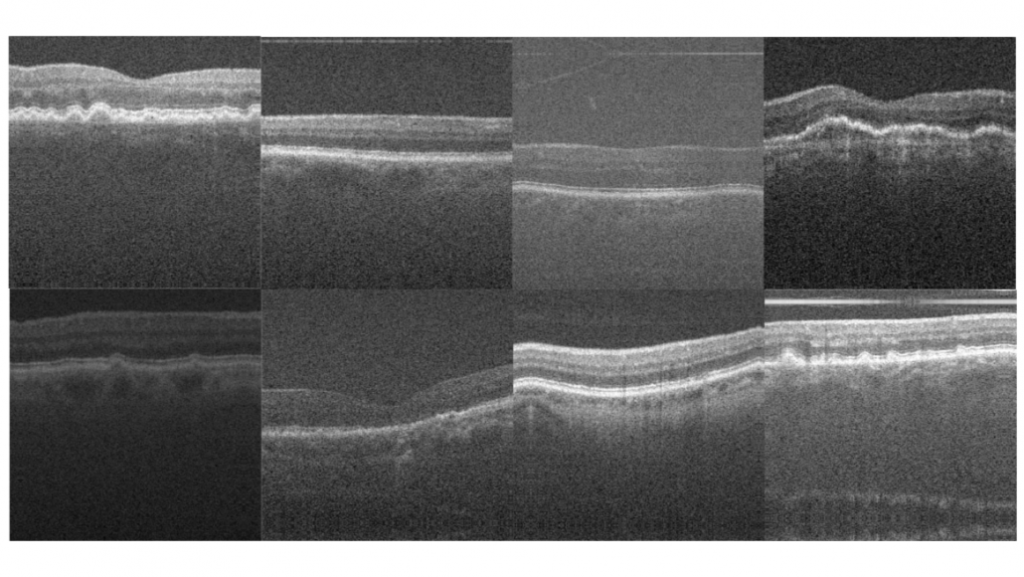
Spiegelen is enkel een soort data augmentatie, binnen het onderzoek zijn meerdere augmentaties gebruikt om een diverse dataset te creëren. Dit om het netwerk niet afhankelijk te maken van één soort OCT-apparaat. Zo zijn alle augmentaties gebaseerd op het nabootsen van beeldkenmerken binnen de verschillende OCT-apparaten. Zo is er gebruik gemaakt van het roteren, verschuiven en inzoomen van de originele afbeeldingen. Ook zijn de beelden donkerder of helderder gemaakt en andere beeld normalisaties. Hierna worden ook de annotaties geaugmenteerd om uiteindelijk overeen te komen met het creëerde OCT-beeld. Hierna worden de beelden gebundeld in partij van acht beelden en annotaties om later te gebruiken tijdens het trainen van het neurale netwerk. Zie een voorbeeld van een partij geaugmenteerd OCT-beelden in figuur 5 waarin duidelijk het verschil in beelden te zien is.
Trainen netwerk
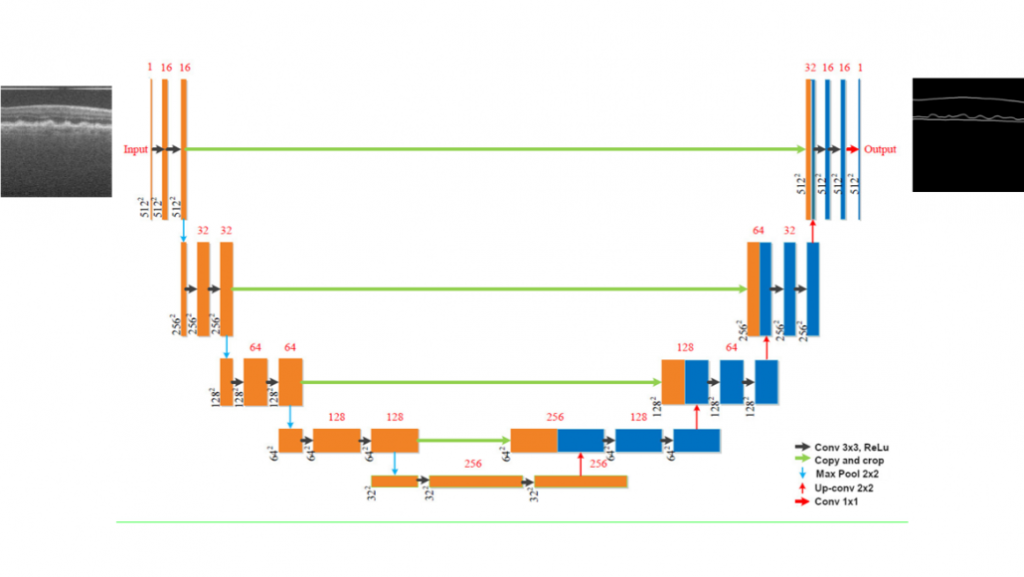
Het trainen van een netwerk is een proces waarbij het neurale netwerk verschillende patronen in de netvlieslagen binnen de OCT-beelden probeert te herkennen, en daarna een segmentatie probeert te voorspellen. Het netwerk krijgt een formule mee om deze voorspellingen te beoordelen, waarbij correct voorspelde segmentatie worden worden “beloond”. Deze beloning vindt plaats wanneer de voorspelde segmentatie overeenkomt met de handmatig geannoteerde segmentatie van deze netvlieslagen. Dit gebeurt door middel van een calculatie van een score over elke pixel binnen de afbeelding. Hierdoor krijgt het model na elke voorspelling feedback over zijn eigen prestatie. Hierna wordt de training van het model gestart waarbij het doel is om zo veel mogelijk beloond te worden. Wanneer er verschillende kenmerken worden gedetecteerd en de voorspelling is correct, maakt het model verbindingen tussen neuronen die worden activeert door deze kenmerken. Dit proces worden vele malen herhaald totdat het model stopt met trainen omdat er geen verbetering meer mogelijk is. Daarna wordt het model samen met alle gemaakte verbinden opgeslagen voor het automatisch segmenteren van de netvlieslagen. Een schematische visualisatie van het getrainde netwerk kunt u vinden in Figuur 6.
Drusen-gebied kwantificatie
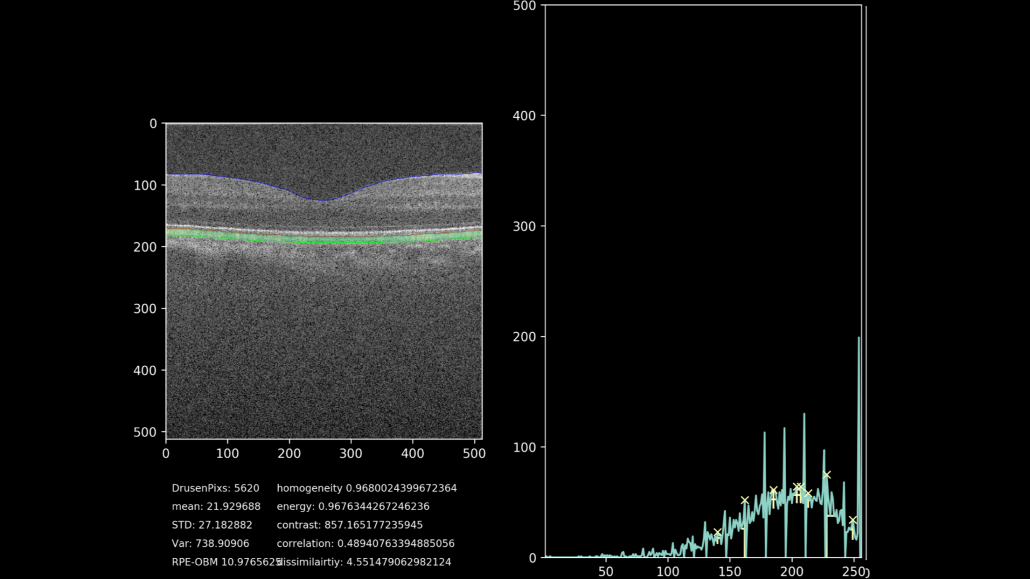
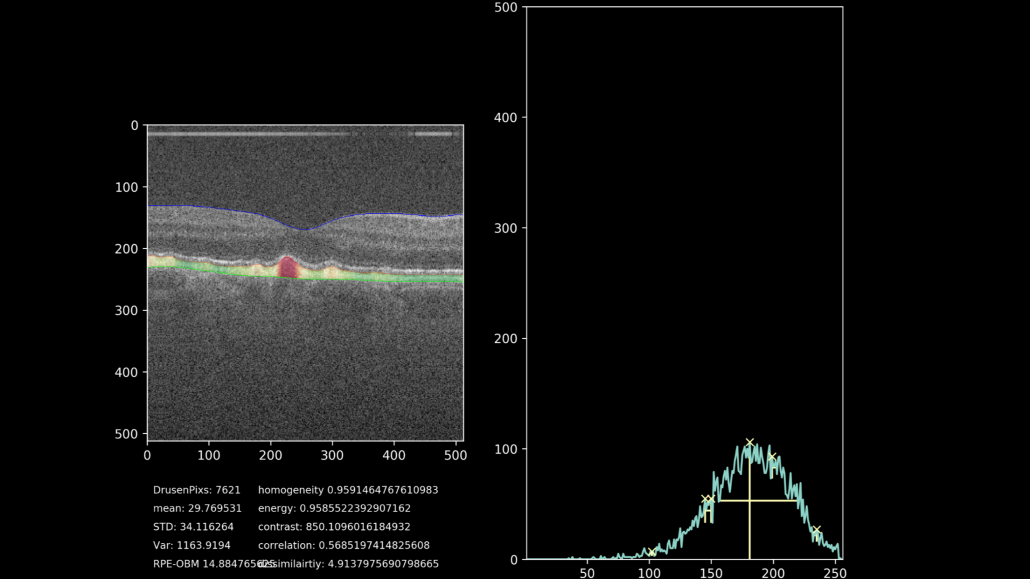
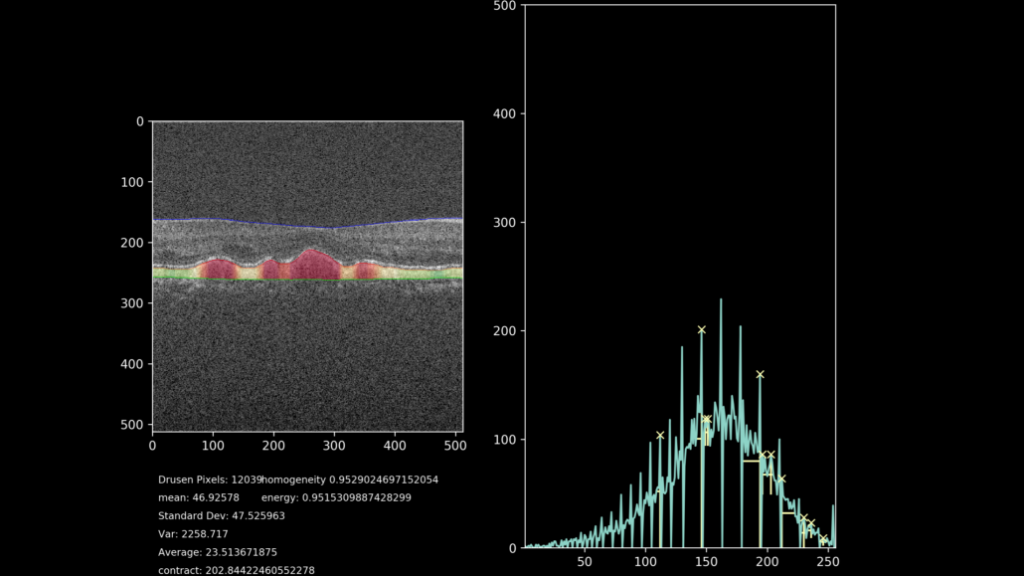
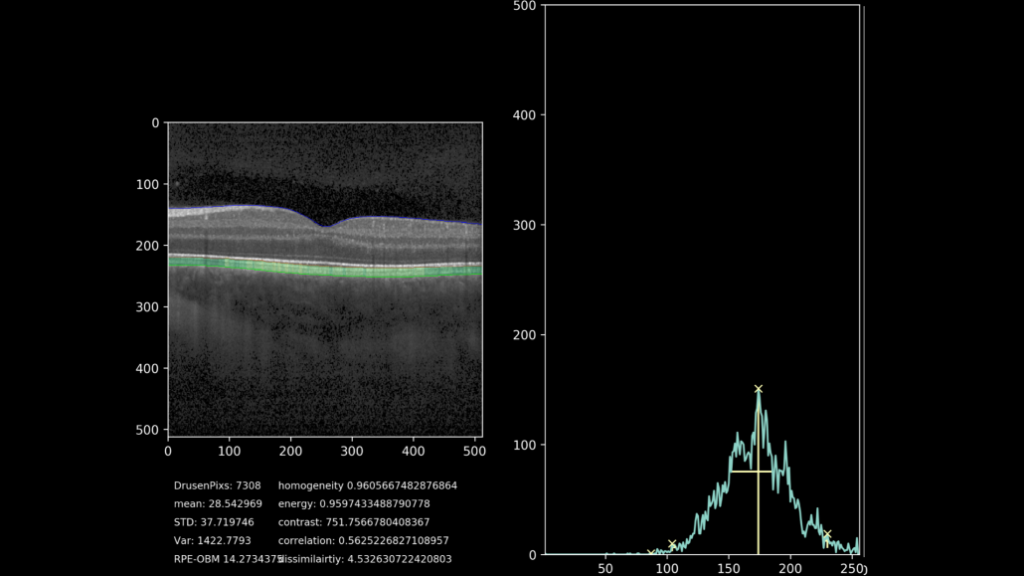
De uiteindelijke doelstelling van het project is het extraheren van progressie-data van het drusen gebied. Hiervoor wordt door middel van het getrainde netwerk, het gebied waarin de drusen liggen gesegmenteerd en geanalyseerd. De hoogte van het complex wordt gemeten met meer kenmerken zoals textuur, homogeniteit, intensiteit en totaal oppervlakte. Hierdoor is het mogelijk om de drusen progressie kwantitatief aan te geven, in plaats van de huidige subjectieve methode. Een voorbeeld van deze kwantificatie samen met een visualisatie van het drusen-gebied kunt u zien in figuur 7. Hierbij is het drusen gebied gekleurd op basis van hoogte tussen het RPE en het BM, waarbij groen een normale hoogte impliceert en oranje/rood een abnormale hoogte.
Resultaten
Voor het testen van het model, is er aan het begin de dataset opgedeeld in een train- en test-partitie. Deze test-partitie bevat enkel beelden wat het model nog nooit heeft gezien. Het getrainde model heeft een DICE-score van 0.979 binnen de test-partitie van de dataset. Dit houdt in dat 97.9% van de door het model voorspelde segmentatie correct is, volgens de handmatige segmentatie. In figuur 8 ziet u een voorbeeld van een voorspelde segmentatie van een gezond netvlies, in figuur 9 ziet u hetzelfde beeld samen met de kwantificatie van het gebied tussen het RPE en BM.
De prestatie van het model is binnen drie andere besloten datasets getest door oogartsen door middel van visuele inspectie. Deze datasets bevatten elk OCT-beelden van andere OCT-apparaten, zoals de Spectralis OCT en de Topcon OCT. Binnen deze dataset concludeerde twee ervaren oogartsen dat de segmentatie de netvlieslagen accuraat volgde. In Figuur 12 een OCT-scan van een gezond oog gemaakt door een Spectralis OCT-apparaat (Heidelberg Engineering).
Discussie
Door middel van de drusen kwantificatie, na het vergaren van een dataset is het wellicht mogelijk om vroegtijdig drusen te herkennen. Waarbij de waarden van bijvoorbeeld gemiddelde hoogte een indicatie kunnen zijn voor drusen in een OCT-beeld. Zo kan er een mogelijke trendlijn ontstaan waaraan de vroegtijdige drusen detectie kan worden gelinkt aan verschillende kenmerken zoals vorm, textuur en intensiteit.
De prestatie van het model in andere datasets is visueel geïnspecteerd door twee ervaren oogartsen. Dit is geen optimale omgeving voor het testen van het getrainde model. Om dit wetenschappelijk aan te tonen, worden twee besloten dataset volledig geannoteerd. Daarna wordt de nauwkeurigheid van de segmentatie berekend in deze beide sets.
Conclusie
Er is een geautomatiseerde manier voor de segmentatie van netvlieslagen is gepresenteerd samen met de mogelijkheid tot het analyseren het drusen oppervlakte. Dit maakt het mogelijk om de drusen progressie kwantitatief te meten, in plaats van de huidig subjectieve interpretaties door middel van visuele vergelijkingen.
Referenties
- Y. Yonekawa, J. Miller, and I. Kim, “Age-related macular degeneration: advances in management and diagnosis,” J.clinical medicine 4, 343–359 (2015).
- R. Kawasaki and Y. Kawasaki, “Innovative approaches in delivery of eye care: Age-related macular degeneration,” Innovative Approaches in the Delivery of Primary and Secondary Eye Care,(Springer, 2019), pp. 147–16
- M. G. Nittala, H. Ruiz-Garcia, and S. R. Sadda, “Accuracy and Reproducibility of Automated Drusen Segmentation “ in Eyes with Non-Neovascular Age-Related Macular Degeneration,” Investig. Ophthalmology & Vis. Sci. 53, 8319 (2012)
- K. N. Khan, O. A. Mahroo, R. S. Khan, M. D. Mohamed, M. McKibbin, A. Bird, M. Michaelides, A. Tufail, and A. T.Moore, “Differentiating drusen: drusen and drusen-like appearances associated with ageing, age-related macular degeneration, inherited eye disease and other pathological processes,” Prog. retinal eye research 53, 70–106 (2016)
- R. D. Jager, W. F. Mieler, and J. W. Miller, “Age-related macular degeneration,” New Engl. J. Medicine 358,2606–2617 (2008)
- A.-R. E. D. S. R. Age-Related Eye Disease Study Research Group, “Risk factors associated with age-related macular degeneration. A case-control study in the age-related eye disease study: Age-Related Eye Disease Study Report Number 3.” Ophthalmology 107, 2224–32 (2000).
- G. Coscas, “Optical coherence tomography in age-related macular degeneration : OCT in AMD”, Springer Medizin (2009)
- M. W. Wintergerst, T. Schultz, J. Birtel, A. K. Schuster, N. Pfeiffer, S. Schmitz-Valckenberg, F. G. Holz, and R. P.Finger, “Algorithms for the Automated Analysis of Age-Related Macular Degeneration Biomarkers on Optical Coherence Tomography: A Systematic Review,” Transl. Vis. Sci. & Technol.6, 10 (2017)
- Farsiu, S., Chiu, S. J., O’Connell, R. V., Folgar, F. A., Yuan, E., Izatt, J. A., … & Age-Related Eye Disease Study 2 Ancillary Spectral Domain Optical Coherence Tomography Study Group. (2014). Quantitative classification of eyes with and without intermediate age-related macular degeneration using optical coherence tomography. Ophthalmology, 121(1), 162-172
Disclaimer
Alle gebruikte beelden binnen dit artikel zijn: (1) volledig geanonimiseerd en behoren tot een publiekelijk toegankelijke dataset van Duke University SD-OCT dataset, of (2) zijn afkomstig vanuit een volume verworven van een OCT-scan van mijn eigen oog.
De schrijver van dit artikel, de betrokken organisaties, partners en agenten geven geen garanties noch expliciete of impliciete verklaringen met betrekking tot de nauwkeurigheid, volledigheid, tijdigheid, vergelijkende of controversiële aard, of het nut van alle medische informatie binnen dit artikel.