Borstkanker is één van de meest voorkomende vormen van kanker en doodsoorzaak nummer één van kanker onder vrouwen [1,2]. Hoewel de huidige beeldvormende technieken, zoals röntgen mammografie, echografie en MRI goed werken bij de meeste patiënten, lijden zij ook aan belangrijke nadelen.
Inleiding
Bij röntgenmammografie zijn dat het gebruik van ioniserende straling, het feit dat de techniek vaak als pijnlijk en oncomfortabel wordt ervaren en het feit dat de techniek slechter presteert bij jonge vrouwen met radiodens borstweefsel [3,4]. Bij echografie zijn het lage zacht-weefsel contrast en de gebruikersafhankelijkheid bekende nadelen [5]. Terwijl MRI een hele hoge sensitiviteit heeft voor de detectie van borstkanker en de resultaten minder afhankelijk zijn van de dichtheid van het borstweefsel, is de specificiteit beperkt, is de injectie van contrastmiddelen noodzakelijk en zijn de resultaten afhankelijk van de fase in de menstruatiecyclus [6-8]. Vandaar dat er een continue zoektocht is naar nieuwe, aanvullende of vervangende, methoden om de borst af te beelden.
Een belangrijk aangrijpingspunt in deze zoektocht wordt gevormd door de tumorangiogenese: het ontspringen van nieuwe bloedvaten uit de bestaande vascularisatie om de kwaadaardige tumor van voldoende voedingsstoffen en zuurstof te voorzien [9]. Tumor angiogenese maakt de ongeremde groei van kwaadaardige tumoren groter dan 1-2 mm mogelijk, maar kan tegelijkertijd ook de aanwezigheid van borstkanker verraden.
Beeldvorming van tumorvascularisatie
Er zijn veel (nieuwe) technieken die zich richten op de afbeelding van tumorvascularisatie voor de detectie of diagnose van borstkanker. Voorbeelden zijn Contrast Enhanced Digital Mammography (CEDM), Contrast Enhanced Ultrasound (CEUS) en (Dynamic Contrast Enhanced) MRI (DCE-MRI) [10]. Zoals al uit de naamgeving is op te maken, is bij het gros van deze technieken nog steeds een (intraveneus geïnjecteerd) contrastmiddel nodig die de tumorvaten zichtbaar maakt. Daarnaast zijn er specifieke nadelen die deze technieken niet optimaal maken voor gebruik in de dagelijkse klinische praktijk. Toch laat de bijna-perfecte sensitiviteit van MRI [11] voor de detectie van borstkanker zien dat de focus op tumorvascularisatie nuttig is.
De toegenomen hoeveelheid vascularisatie rond een borstmaligniteit zorgt er ook voor dat er lokaal een hogere concentratie van hemoglobine aanwezig is en dat biedt perspectieven voor optische beeldvormende technieken. Hemoglobine is namelijk een sterkste intrinsieke absorbeerder van nabij-infrarood licht (700-1100 nm), waardoor de absorptiecoëfficiënt van bloedvaten significant hoger is dan de absorptiecoëfficiënt van het omliggende borstweefsel [12]. Daarnaast vindt de nabij-infrarode absorptie ook plaats door water, vet en collageen, en alle drie deze chromoforen zijn in concentratie veranderd ter plaatse van een maligniteit [13-15]. Tot slot is ook de lichtverstrooiing door de hogere celdichtheid toegenomen [13]. Inderdaad laten technieken als Diffuse Optical Imaging (DOI) en Diffuse Optical Spectroscopy (DOS) zien dat borstkanker kan worden afgebeeld met optische beeldvormende technieken [13,16,17]. Dit gebeurt zonder ioniserende straling, zonder gebruik van te injecteren contrastmiddelen en zonder de nare borstcompressie die nodig is bij mammografie.
Toch zijn de puur optische beeldvormende methoden niet dé oplossing. Licht lijdt namelijk aan één groot nadeel en dat is de sterke verstrooiing in weefsel. Door deze verstrooiing is al op een aantal mm diepte niet meer met grote nauwkeurigheid te zeggen waar het licht precies is geweest, dit maakt niet alleen dat het doordringend vermogen van licht beperkt is, maar vooral dat de resolutie sterk afneemt met de diepte [14,18]. Zouden we de voordelen van optische beeldvorming echter kunnen combineren met een goede resolutie, dan hadden we de ideale techniek voor beeldvorming van de borst in handen.
Fotoakoestische mammografie
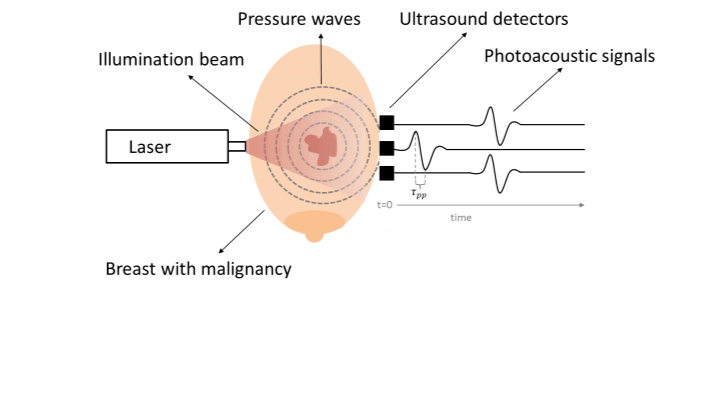
Fotoakoestische mammografie is zo’n techniek. Zoals de naam al impliceert, combineert fotoakoestiek het afbeelden van licht (foto) met de detectie van geluid (akoestiek). Bij fotoakoestische mammografie wordt de borst belicht met korte pulsen van nabij infrarood licht. Hoewel bij puur optische technieken de verstrooiing van licht alleen maar een nadeel was, is dat bij fotoakoestiek deels ook een voordeel: door die verstrooiing komt het licht op veel plekken in de borst terecht, ook bij de tumor waar het licht sterker wordt geabsorbeerd dan in het omringende weefsel. Hoe het licht die locatie precies bereikt heeft, is niet van belang. Ten gevolge van die absorptie vindt er een kleine temperatuurtoename plaats en via het proces van thermo-elastische relaxatie leidt dat tot een volume-uitzetting die zich voortplant als een drukgolf door het weefsel [19].
Als de lichtpuls korter is dan de thermische en stress relaxatie tijden, dan is de initiële druk p0 (Pa) na absorptie proportioneel aan de lokaal geabsorbeerde energiedichtheid Ea ([J/m3]), de lokale absorptiecoefficient van het weefsel (μa [m-1]) en de dimensieloze Grüneisencoefficient (Γ):
p0=EaΓ (1)
Eawordt omschreven door
Ea=Fμa (2)
waarin F de optische fluence is (Jm-2) en µa de optische absorptiecoefficient (m-1). Γ wordt gegeven als:
Γ=βc2⁄Cp (3)
met β de isobarische volume expansiecoefficiënt in K-1, c de snelheid van geluid in het medium (m s-1) en Cp de specifieke warmte in J/(K kg).
De gegenereerde drukgolf heeft zijn frequentie in het ultrasoundregime en kan aan de buitenkant van de borst worden gedetecteerd met ultrageluidsdetectoren met de juiste frequentie en bandbreedte. Hierbij is het belangrijk dat de afmetingen van de ‘absorbeerder’, de duur en dus de frequentie van de drukgolf bepaalt. Voor een bolvormige absorbeerder met straal r0 , wordt een typische bipolaire puls gegenereerd (zie Figuur 2), waarvan de piek-piek tijd τpp wordt omschreven door [20]:
τpp=√(2 r0/c) (4)
Via de juiste keuze van detectorelementen kan dus in theorie de nadruk worden gelegd op het afbeelden van afzonderlijke bloedvaten in de borst of juist op het afbeelden van de tumor als geheel.
De Twente Photoacoustic Mammoscope (PAM)
Deze techniek is aan de Universiteit Twente een aantal jaar geleden toegepast in de Twente Photoacoustic Mammoscope (PAM) (Figuur 3) [21,22]. Tijdens de meting ligt de patiënte op haar buik op het bed, met haar borst door een uitsparing in het bed. Onder het bed bevindt zich de laser die pulst op 1064 nm met 10 ns pulsen met een frequentie van 10 Hz. De borst is contact met de glasplaat voor laserbelichting aan de craniale kant en de ultrageluidsdetectormatrix aan de caudale kant. De maximale lichtintensiteit op de huid van de borst is 10 mJ/cm2. De vlakke ultrageluidsdetector bestaat uit 590 elementen, die maximaal gevoelig zijn op 1 MHz en een bandbreedte van 130% hebben. Alle gedetecteerde signalen tijdens een fotoakoestisch onderzoek worden offline gereconstrueerd met een ‘filtered backprojection’ algoritme.
Dit apparaat is ontworpen voor onderzoeksdoeleinden en zal derhalve in deze vorm nooit in de dagelijkse klinische praktijk kunnen worden gebruikt, maar omdat het apparaat vrij rechtlijnig werkt, kan er relatief duidelijk interpreteerbare informatie over de combinatie fotoakoestiek en borstweefsel worden verkregen die nodig is om toekomstig apparatuur zo goed en betrouwbaar mogelijk te maken. Die unieke ervaring van het verzamelen van fotoakoestische data van patiënten met borstkanker heeft van december 2010 tot juni 2013 plaatsgevonden.
De Medisch Ethische Toetsingscommissie (METC) Twente heeft het studieprotocol en de informed consent procedure goedgekeurd. In totaal hebben 73 patiënten vrijwillig deelgenomen aan de metingen. In deze studie lag de nadruk op die patiënten met afwijkingen die verdacht waren voor de aanwezigheid van maligniteit. Het lijkt counter-intuïtief om te beginnen met het onderzoeken van de abnormale borst als nog niet bekend is hoe de gezonde borst eruit ziet. Enerzijds was deze keuze gedwongen door noodzaak: we konden slechts een beperkt gedeelte van de borst afbeelden en moesten dus een duidelijk richtpunt hebben voor de scan. Anderzijds hebben we heel bewust gekozen voor patiënten met zeer verdachte afwijkingen, dit is namelijk de patiëntgroep waarvan we röntgenbeelden, echobeelden, pathologie en vaak ook MRI-beelden beschikbaar hebben en dus de patiëntgroep waarvan we met grote zekerheid konden zeggen waar we naar keken. Op die manier konden we eerst leren hoe maligniteiten, omringd door gezond weefsel, eruit zagen op een fotoakoestisch mammogram en welke factoren er bij de beeldvorming een rol speelden, voordat we naar onbekende borsten met mogelijk vele zichtbare onbekende structuren gingen kijken.
De belangrijkste bevindingen in de verschillende fases van de studie waren:
- Fotoakoestische mammografie, met 1064 nm licht kan maligniteiten afbeelden met hoog beeldcontrast: vrijwel alle maligniteiten waren zichtbaar;
- De resultaten zijn onafhankelijk van de (mammografisch bepaalde) dichtheid van het borstweefsel;
- De fotoakoestsiche weergave van maligniteiten, gebruikmakend van 1064 nm licht, is voor een groot deel het gevolg van de verandering in tumorvascularisatie, maar de bijdrage van andere chromoforen kan niet worden uitgesloten
- Goedaardige cystes kunnen niet altijd onderscheiden worden van maligniteiten met PAM, maar simulaties laten zien dat cystes een bepaalde fotoakoestische handtekening hebben die ze verschillend maakt van maligniteiten als voor een andere afbeeldingsconfiguratie wordt gekozen;
- Met slechts één golflengte laat de specificiteit van PAM waarschijnlijk nog te wensen over.
Fotoakoestiek kan maligniteiten afbeelden met hoog beeld-contrast
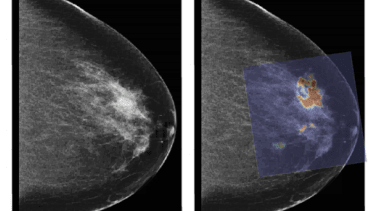
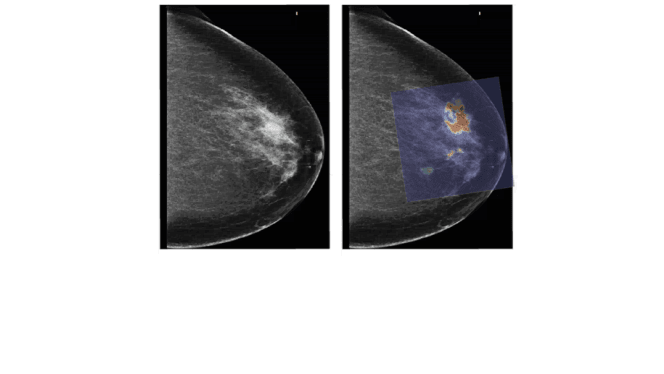
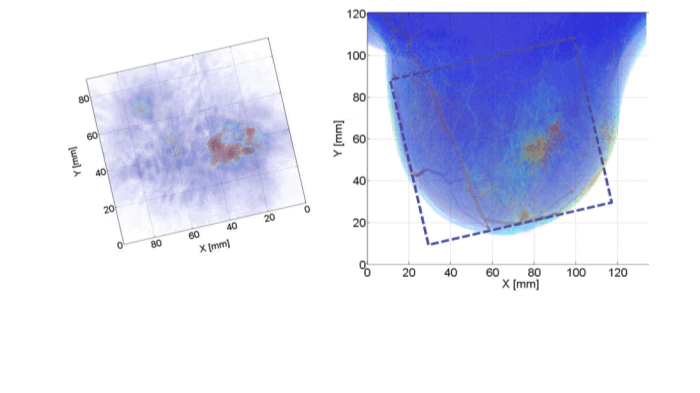
Al in de eerste fase van de studie bleek dat PAM maligniteiten in beeld kan brengen met een heel hoog beeldcontrast: alle tien de gevallen van borstkanker waren duidelijk zichtbaar in het fotoakoestisch mammogram [23]. In deze periode kon echter maar een zeer beperkt gedeelte van de borst worden afgebeeld, waardoor de focus moest liggen op palpabele afwijkingen en de reconstructie van de afwijkingen niet optimaal was. Technologische ontwikkelingen hebben ertoe geleid dat in de laatste 39 patiënten niet alleen een groter gedeelte van de borst kon worden afgebeeld, maar vooral dat de metingen beter gestandaardiseerd plaatsvonden, waardoor een één op één vergelijkingen tussen PAMbeelden, röntgenbeelden en indien aanwezig MRI-beelden kon worden gemaakt. Van deze laatste 39 patiënten hadden er 31 borstkanker, waarvan deze in 30 gevallen in beeld konden worden gebracht met PAM. In de ene patiënt waar de tumor niet zichtbaar was op het fotoakoestisch mammogram, kan mispositionering niet worden uitgesloten noch bevestigd. In drie gevallen was de afwijking niet zichtbaar op het röntgenmammogram, maar kon deze met hoog beeldcontrast worden afgebeeld met PAM.
De afwijking tussen de geschatte grootte op de beelden t.o.v. de werkelijke grote gemeten door de patholoog, was voor PAM vergelijkbaar met röntgenmammografie en echografie en veel beter dan voor MRI. De mate van contrast op de PAMbeelden kon niet worden gekoppeld aan het type tumor, de tumorstadiëring of de hormoonreceptorstatus in deze relatief kleine groep patiënten.
De resultaten zijn onafhankelijk van de mammografisch bepaalde dichtheid van het borstweefsel
Voor alle patiënten met borstkanker hebben één of meerdere radiologen de dichtheid van het borstweefsel op het röntgenmammogram geschat op basis van de ‘BI-RADS density classification’ (www.acr.org). Het is bekend dat de betrouwbaarheid van röntgenmammografie afneemt met de dichtheid van het borstweefsel [4]. In de verschillende fases van de studies is zowel het röntgencontrast als het fotoakoestische contrast van de afwijkingen in de hoge dichtheid borsten vergeleken met die in de lage dichtheid borsten. In tegenstelling tot bij röntgenmammografie, bleek het contrast van de afwijking op het fotoakoestisch mammogram niet afhankelijk van de dichtheid van het borstweefsel. Hoewel het hier om kleine onderzoeksgroepen gaat (10 en 31 patiënten), geeft deze uitkomst aan dat vervolgonderzoek naar de relatie tussen de borstdichtheid en de fotoakoestische prestatie zinvol is. Een onafhankelijkheid van de dichtheid van borstkanker biedt perspectieven voor de (veelal jonge) vrouwen met dicht borstweefsel die in een risicogroep vallen en regelmatig worden gecontroleerd op de aanwezigheid van borstkanker.
Het fotoakoestisch beeld op 1064 nm is grotendeels het gevolg van tumorvascularisatie
Mede door de specifieke fotoakoestische verschijningsvorm van de afwijkingen in de eerste fase van de studie, ontstond de vraag in welke mate het fotoakoestische beeld werd veroorzaakt door de toegenomen tumorvascularisatie. Het beantwoorden van deze vraag is belangrijk om de toekomstige apparatuur zo optimaal mogelijk te ontwikkelen, maar ook om al iets over de potentie van de techniek voor het onderscheid tussen bepaalde goed- en kwaadaardige afwijkingen te kunnen zeggen.
Fotoakoestische beelden zijn vergeleken met MRI-beelden, de gouden standaard voor het afbeelden van tumorvascularisatie. Daarnaast werd bij een aantal proefpersonen een extra vaatkleuring op de histopathologische coupes toegepast, zodat de fotoakoestische verschijning kon worden vergeleken met het patroon van vaataankleuring. In het algemeen konden er drie verschillende verschijningsvormen in de fotoakoestische afbeeldingen worden waargenomen die grote overeenkomsten vertoonden met de aankleuringspatronen die bekend zijn van MRI. Ook in de één op één vergelijking waren er grote overeenkomsten tussen fotoakoestiek en MRI, met name op het gebied van verschijningsvorm en locatie en in mindere mate ook met betrekking tot de grootte. De vergelijking met de histhopathologische coupes liet in vier van de vijf gevallen overeenkomsten zien tussen de fotoakoestische verschijningsvorm en de vaataankleuring. Toch konden niet alle fotoakoestische aspecten worden verklaard op grond van een toegenomen vaatdichtheid. Deze resultaten laten zien dat het aannemelijk is dat het fotoakoestische beeld inderdaad voor een groot deel wordt veroorzaakt door de toegenomen vascularisatie, maar dat de bijdrage van andere chromoforen en met name van water nog niet kan worden uitgesloten. Toekomstige onderzoek met meerdere golflengtes zal hier meer uitsluitsel over moeten geven [24].
Goedaardige cystes
Het zichtbaar kunnen maken van kwaadaardige afwijkingen is cruciaal, maar minstens zo belangrijk is het om deze te kunnen onderscheiden van veelvoorkomende goedaardige afwijkingen, zoals bijvoorbeeld cysten. Cystes zijn onschuldige met vocht gevulde holtes die bij veel vrouwen voorkomen. Met ultrageluid kunnen deze afwijkingen goed worden gediagnosticeerd. Om meer inzicht te krijgen in de fotoakoestische verschijningsvorm van cystes zijn computersimulaties, fantoommetingen en proefpersoonmetingen gedaan [25]. Uit deze simulaties en metingen bleek dat cystes zichtbaar kunnen zijn met de huidige configuratie van PAM. Vaak zijn ze als twee hoogcontrast gebieden zichtbaar die de voor- en de achterkant van de cyste representeren. Met de huidige vlakke geometrie is het echter niet mogelijk om meerdere maligniteiten eenduidig te onderscheiden van een cyste. De simulaties en fantoommetingen lieten echter ook zien dat de vorm van de fotoakoestische signalen van cystes kenmerkende informatie bevat. Daardoor valt te verwachten dat met een tomografische configuratie en de juiste reconstructiemethoden, cystes in toekomstige apparatuur wel te onderscheiden zijn van maligniteiten [25].
Hoogcontrast gebieden
In deze studie waren bijna alle maligniteiten zichtbaar als hoog-contrast gebied. Dat is een positief resultaat en de eerste belangrijke stap die genomen moest worden. Het zegt echter nog weinig, want voor een goede beeldvormende discipline moeten zulke maligniteiten ook herkend worden in een fotoakoestisch mammogram van een ‘onbekende ‘ borst en moeten deze afwijkingen duidelijk onderscheiden kunnen worden van goedaardige afwijkingen. Zover is het voorlopig nog niet. In deze studie werd in een aantal gevallen hoog-contrast gebieden gedetecteerd die niet met zekerheid konden worden gerelateerd aan bekende structuren in de borst. Deze resultaten laten zien dat fotoakoestische mammografie met de huidige afbeeldingsgeometrie en slechts één golflengte niet geschikt zal zijn als diagnostische of screeningsmethode. Hiervoor zal een systeem nodig zijn dat de borst tomografisch en met meerdere golflengten afbeeldt.
Deze resultaten onderschrijven echter wel de keuze voor een studie-opzet waarin eerst heel gericht naar afwijkingen werd gekeken, voordat onderzoek werd gedaan naar gezonde borsten. Het niet herkennen van structuren in de borst kan voor veel verwarring zorgen en een onterecht negatief oordeel over een nieuwe techniek, zoals fotoakoestische mammografie, geven. De vlakke geometrie en het gebruik van één golflengte van PAM heeft het mogelijk gemaakt om exact te weten waar de fotoakoestische signalen vandaar kwamen en van daaruit te leren hoe maligniteiten eruit zien op een fotoakoestisch mammogram, hoe cystes eruit kunnen zien en met name om te leren en te ervaren hoe de techniek moet worden verbeterd. Het is nu tijd voor een stap vooruit.
Het vervolg
Deze studie heeft veel aanknopingspunten gegeven voor vervolgonderzoek. Het feit dat op-één-na alle afwijkingen zichtbaar konden worden gemaakt op het fotoakoestische mammogram en dat de afbeeldingsresultaten onafhankelijk waren van de dichtheid van het borst weefsel, geeft aan dat de techniek potentie heeft. Met de recent ontwikkelde PAM 2 die de borst wel tomografisch afbeeldt en daarbij twee golflengtes en een gevoeligere detector gebruikt, zou daarom onderzoek gedaan moeten worden in grotere groepen patiënten, naar de verschijning van goed- en kwaadaardig weefsel en uiteindelijk ook naar het beeld van gezonde borsten. Het gebruik van meerdere golflengten zal de specificiteit van de techniek waarschijnlijk ten goede komen en biedt daarnaast mogelijkheden voor vervolgonderzoek naar de overeenkomst tussen de fotoakoestische verschijning en de mate van tumorangiogenese, het soort maligniteit en de gradering van de maligniteit. Al deze kennis moet bijdragen aan de ontwikkeling van een optimaal apparaat voor borstkankerdiagnose of –detectie waarbij geen ioniserende straling of contrastmiddelen nodig zijn en die vrouwvriendelijk, maar vooral betrouwbaar en breed inzetbaar is.
Referenties
- Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA: a cancer journal for clinicians 2011;61:69-90.
- Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013. CA: a cancer journal for clinicians 2013;63:11-30.
- Di Nubila B, Cassano E, Urban LA, et al. Radiological features and pathological-biological correlations in 348 women with breast cancer under 35 years old. Breast 2006;15:744-53.
- Jackson VP, Hendrick RE, Feig SA, Kopans DB. Imaging of the radiographically dense breast. Radiology 1993;188:297-301.
- Vassiou K, Kanavou T, Vlychou M, et al. Characterization of breast lesions with CE-MR multimodal morphological and kinetic analysis: comparison with conventional mammography and high-resolution ultrasound. European journal of radiology 2009;70:69-76.
- Heywang-Kobrunner SH, Schreer I, Heindel W, Katalinic A. Imaging studies for the early detection of breast cancer. Deutsches Arzteblatt international 2008;105:541-7.
- Kuhl C. The current status of breast MR imaging. Part I. Choice of technique, image interpretation, diagnostic accuracy, and transfer to clinical practice. Radiology 2007;244:356-78.
- Uematsu T, Yuen S, Kasami M, Uchida Y. Comparison of magnetic resonance imaging, multidetector row computed tomography, ultrasonography, and mammography for tumor extension of breast cancer. Breast cancer research and treatment 2008;112:461-74.
- Folkman J. Angiogenesis and breast cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 1994;12:441-3.
- Heijblom M, Klaase JM, van den Engh FM, van Leeuwen TG, Steenbergen W, Manohar S. Imaging tumor vascularization for detection and diagnosis of breast cancer. Technology in cancer research & treatment 2011;10:607-23.
- Bluemke DA, Gatsonis CA, Chen MH, et al. Magnetic resonance imaging of the breast prior to biopsy. JAMA : the journal of the American Medical Association 2004;292:2735-42.
- Yu Y, Liu N, Sassaroli A, Fantini S. Near-infrared spectral imaging of the female breast for quantitative oximetry in optical mammography. Applied optics 2009;48:D225-35.
- Choe R, Konecky SD, Corlu A, et al. Differentiation of benign and malignant breast tumors by in-vivo three-dimensional parallel-plate diffuse optical tomography. Journal of biomedical optics 2009;14:024020.
- Pogue BW, Jiang S, Dehghani H, et al. Characterization of hemoglobin, water, and NIR scattering in breast tissue: analysis of intersubject variability and menstrual cycle changes. Journal of biomedical optics 2004;9:541-52.
- Tromberg BJ, Pogue BW, Paulsen KD, Yodh AG, Boas DA, Cerussi AE. Assessing the future of diffuse optical imaging technologies for breast cancer management. Medical physics 2008;35:2443-51.
- Enfield LC, Gibson AP, Everdell NL, et al. Three-dimensional time-resolved optical mammography of the uncompressed breast. Applied optics 2007;46:3628-38.
- Fournier LS, Vanel D, Athanasiou A, et al. Dynamic optical breast imaging: a novel technique to detect and characterize tumor vessels. European journal of radiology 2009;69:43-9.
- Gibson A, Dehghani H. Diffuse optical imaging. Philosophical transactions Series A, Mathematical, physical, and engineering sciences 2009;367:3055-72.
- Beard P. Biomedical photoacoustic imaging. Interface focus 2011;1:602-31.
- Sigrist MW, Kneubuhl FK. Laser-Generated Stress Waves in Liquids. J Acoust Soc Am 1978;64:1652-63.
- Piras D, Xia WF, Steenbergen W, van Leeuwen TG, Manohar S. Photoacoustic Imaging of the Breast Using the Twente Photoacoustic Mammoscope: Present Status and Future Perspectives. Ieee J Sel Top Quant 2010;16:730-9.
- Manohar S, Kharine A, van Hespen JC, Steenbergen W, van Leeuwen TG. The Twente Photoacoustic Mammoscope: system overview and performance. Physics in medicine and biology 2005;50:2543-57.
- Heijblom M, Piras D, Xia W, et al. Visualizing breast cancer using the Twente photoacoustic mammoscope: What do we learn from twelve new patient measurements? Optics express 2012;20:11582-97.
- Heijblom M, Piras D, van den Engh FM, et al. Photoacoustic imaging of breast tumor vascularization: a comparison with MRI and histopathology. Proc Spie 2013;8800.
- Heijblom M, Piras D, Maartens E, et al. Appearance of breast cysts in planar geometry photoacoustic mammography using 1064-nm excitation. Journal of biomedical optics 2013;18; 126009-1:11.