Hyperthermie
Maarten Paulides, onderzoeker en universitair docent bij de afdeling radiotherapie van het Erasmus Medisch Centrum (Erasmus MC) weet alles over deze eerste term: hyperthermie.
Bij hyperthermie worden kankercellen verwarmd tot zij doodgaan, vertelt hij. Vaak wordt hyperthermie toegevoegd aan radiotherapie of chemotherapie. Hierdoor kunnen de doses daarvan omlaag. Voor veel tumorlocaties is aangetoond dat dit zorgt voor veel succesvollere behandeling.
Bij hyperthermie worden cellen verwarmd met niet-ioniserende elektromagnetische velden met een frequentie tussen de 500kHz en 1GHz.
In tumoren zitten gebieden met goede en slechte doorbloeding (figuur 1), legt Paulides uit. Voor de gebieden met een slechte doorbloeding is het nodig dat de doorbloeding verbetert (bij chemotherapie) en er voldoende zuurstof (bij radiotherapie) aanwezig is. Dit bereikt men met hyperthermie.
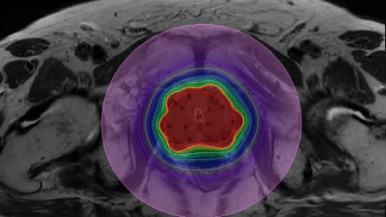
In het Erasmus MC zal in juli de eerste patiënt worden behandeld een geavanceerde 3D-temperatuurscan. De patiënt wordt tijdens het bestralingsschema (dagelijks) eenmaal in de week behandeld met hyperthermie.
Radionuclide therapie in ontwikkeling
Sommige patiënten komen alleen helemaal niet meer toe aan chemotherapie, vertelt Arthur van Lingen, klinisch fysicus op de afdeling Nucleaire Geneeskunde van het VU Medisch Centrum. Patiënten met prostaatkanker dat is uitgezaaid in de botten komen vrijwel nooit aan chemotherapie toe. Zij zijn daar te zwak voor of de bijwerkingen van chemotherapie tast de levenskwaliteit aan. Ook kunnen uitzaaiingen veel pijn veroorzaken. Zij kunnen niet meer genezen en de gemiddelde levensverwachting van deze patiënten is ongeveer een jaar.
Behandeling met Radium-223 kan hierbij helpen, stelt de nucleaire geneeskundige. In een half jaar tijd zes keer een bezoek aan het ziekenhuis is volgens hem voldoende om patiënten een langer en beter leven te geven. En dat terwijl er nauwelijks bijwerkingen zijn.
Radium 223-dichloride is een alfa-emitter, dat zich gedraagt als calcium en complexen vormt met het botmineraal hydroxyapatiet. De hoge lineaire energieoverdracht van alfa-emitters (80 keV / micrometer) beschadigt het dubbelstrengs-DNA in naastgelegen tumorcellen. Door het beperkte bereik van deze alfa-emitter ( minder dan 100 micrometer) (figuur 2) blijft de schade aan het omliggende gezonde weefsel beperkt.
Naast Radium-223 maakt Van Lingen veel gebruik van Jodium-131 voor de bestrijding van schildklierkanker en Hyperthyreoïdie dat wordt veroorzaakt door een te actieve schildklier waardoor er een overschot aan schildklierhormoon aanwezig is, zoals bij de ziekte van Graves.
Patiënten met deze aandoeningen krijgen jodium-131 toegediend. Dit wordt voornamelijk door de "zieke" cellen opgenomen. De straling van dit radioactieve jodium vernietigt deze cellen zonder veel schade aan het omliggende weefsel aan te richten. Door de juiste isotoop deel te laten uitmaken van een slim gekozen radiofarmacon, beperkt men de schade aan gezonde cellen zo veel mogelijk terwijl de zieke cellen worden gedood.
Behandelen met licht
Kanker kun je ook bestrijden met licht. Dat toont medisch technicus Jan Bonne Aans (afdeling Hoofd-halsoncologie en -chirurgie van het Antonie Leeuwenhoek aan.
Met Photodynamic Therapy (PDT) wordt enige tijd na toediening van een lichtgevoelige stof het te behandelen weefsel belicht. Door fotochemische reacties sterft het weefsel vervolgens af. PDT kan voor verschillende typen en stadia kanker worden toegepast.
PDT is gebaseerd op de interactie tussen een lichtgevoelige stof, zuurstof en licht (figuur 3). In 1900 werdhieral melding van gemaaktdoor de Duitse student Raab tegen zijn leraar Tappeiner, citaat: "I don't understand it Dr. von Tappeiner, the paramecia were all wiggling just fine a minute ago, but now these over by the window seem to be dead".
In 1976 vond de eerste PDT plaats in Nederland, ongeveer 10 jaar eerder gebeurde dit al in de VS. Een nadeel van de behandeling toen was dat het gezonde weefsel ook werd beschadigd. Door de komst van laserlicht en betere geleiders is PDT nu veel gerichter en lokaal toepasbaar.
Bijwerkingen zijn daardoor minimaal geworden, al moeten patiënten wel oppassen voor te veel zon. Dit is met name in de zomermaanden erg lastig. Maar ook dit wordt steeds minder, betere fotosynthesizers zorgen ervoor dat minder van de vloeistof geïnjecteerd hoeft te worden en de patiënten zich weer sneller aan zonlicht kunnen blootstellen.
PDT wordt therapeutisch toegepast in de oncologie bij KNO, prostaat, galwegen, brein en huidkanker. Daarnaast wordt PDT gebruikt bij dermatologie (Actinische keratose, schimmelinfectie, acne, psoriasis) en oogheelkunde (blindheid/AMD).
Het enige nadeel van PDT is littekenweefsel. Er is minimale morbiditeit en geen radiotoxiciteit, het is goedkoop en is op dezelfde plek te herhalen.PDT kan niet toegepast worden wanneer fototoxiciteit onacceptabel is of bij botingroei.
Minder invasieve behandelingen
In plaats van opereren zijn er ook minder invasieve behandelingen. Interventieradioloog Warner Prevoo van het Antonie van Leeuwenhoek Ziekenhuis is gespecialiseerd in minimaal invasieve beeldgestuurde behandelingen, zoals bijvoorbeeld radiofrequentie-ablatie (RFA).
Dit alternatief naast de traditionele pijlers van chirurgie, chemotherapie en radiotherapie is inzetbaar bij allerlei verschillende kankersoorten, maar gebruikt verschillende technieken.
Zo is er de keuze tussen radiofrequentie-ablatie (RFA) of microgolfablatie (MWA). Deze vormen van thermische ablatie worden toegepast bij verschillende tumorsoorten, waaronder tumoren in de lever, nier, long, het bot, de mamma of in weke delen. Ook wanneer de tumor niet chirurgisch te verwijderen is bij bijvoorbeeld comorbiditeit of als de patiënt specifiek om deze behandeling vraagt, wordt er gekozen voor thermische ablatie.
Bij beide behandelingen worden naalden ingebracht in de tumor. Bij RFA wordt deze naald op een generator aangesloten die de cellen laat trillen. Door de warmte die bij de trilling ontstaat, worden de kankercellen gedood. De naalden die bij MWA de tumor aanprikken zenden in plaats van radiogolven microgolven uit die watermoleculen in beweging brengen waardoor de tumor opwarmt.
Beide technieken gebruiken elektromagnetische energie, bij RFA is de gebruikte frequentie lager (375kHz-500kHz) dan bij MWA (915MHz-2450MHz).
Er zijn wel een aantal voordelen voor MWA ten op zichte van RFA (figuur 4). Zo wordt de temperatuur in tumorcellen bij MWA hoger waardoor zij sneller doodgaan. Bovendien is de behandeling sneller en kan een groter volume in een keer behandeld worden. Daarnaast is het ook geschikt voor “natte massa” en heeft het een verbeterd convectieprofiel. Bovendien zijn er geen ground pads nodig, en misschien wel het belangrijkste: MWA is minder pijnlijk dan RFA.
Ideale ablatie is nog niet haalbaar. Ideaal is complete ablatie (groot volume) met een voorspelbare coagulatie/ablatie volume en met minimale incisies/morbiditeit. Deze ablatie zou bovendien snel, makkelijk en goedkoop zijn. Ook moet het te combineren zijn met andere technieken en herhaald kunnen worden in hetzelfde gebied. Maar zo ver zijn we nog niet.
De nano-poriën openen
Een paar van de nadelen van RFA en MWA zijn op te lossen met irreversible electroporation (IRE), stelde Martijn Meijerink, interventieradioloog in het VU Medisch Centrum.
Bij deze nieuwe techniek, dat alleen nog in Amsterdam (VU en AMC) en in Leiden wordt toegepast (figuur 5), worden aan de tumor meerdere korte elektrische stroomstoten toegediend waardoor minuscule 'nano-poriën' in de wand van de cellen ontstaan, waarna de cel opzwelt en daarna dood gaat. Het apparaat dat gebruikt wordt voor deze techniek heet de “NanoKnife”.
Net als bij RFA en MWA worden bij IRE naalden (maximaal zes) onder beeldsturing van een CT de tumor ingebracht. Op de naaldelektroden wordt een spanning van 1250-1500V/cm gezet. De stroom die door de naalden gaat kan wel oplopen tot 40 ampère.
In het begin van de ontwikkeling van IRE kwam het soms voor dat een patiënt door deze flinke stroomstoten een hartstilstand kreeg, maar tegenwoordig geeft men de pulsen op het P-gedeelte van het QRS-complex; de patiënt krijgt dan snel 10 korte pulsen (70μs) achter elkaar. Totaal worden er 70 tot 100 pulsen gegeven.
In tegenstelling tot bij RFA en MWA wordt bij IRE alleen tumorweefsel vernietigd en niet het weefsel dat eromheen ligt. Hierdoor raken kwetsbare structuren zoals bloedvaten en zenuwen niet beschadigd, wat kan leiden tot ernstige complicaties.
Daarnaast heeft IRE geen last van het “heat-sink effect” (vooral bij RFA) waarbij warmteverlies optreedt tijdens de verhitting van tumoren die vlakbij grote bloedvaten liggen. Het stromende bloed voert de hitte gedeeltelijk af, waardoor tumorcellen niet heet genoeg kunnen worden en daardoor overleven. Omdat IRE niet op warmte berust, is er geen sprake van “heat-sink”. Hierdoor kan een tumor die vlakbij een groot bloedvat ligt beter verwijderd worden.
Ook is gebleken dat het bindweefsel waaraan (grote) bloedvaten, galwegen en zenuwen hun stevigheid en vorm ontlenen, niet vernietigd wordt. Met name patiënten met tumoren die vanwege hun moeilijke ligging niet geschikt zijn voor chirurgische verwijdering of verhitting, komen mogelijk in aanmerking voor behandeling met IRE. Voorbeelden zijn levertumoren die vlakbij bloedvaten of galwegen liggen, niertumoren die vlakbij het nierbekken liggen en alvleesklierkanker.
In de toekomst wordt ook gekeken naar IRE voor prostaattumoren.
Radiotherapie blijft bestaan
Wijzer geworden van de ontwikkelingen in het vakgebied ging de NVKFM na deze interessante lezingen verder met het lustrumprogramma. Maar niet voor er een belangrijke vraag beantwoord werd: hoe zit het met radiotherapie? Kunnen NVKFM’ers over een paar jaar hun biezen pakken of blijft radiotherapie nodig? Volgens Martijn Meijerink zal radiotherapie in ieder geval op de eerste plaats blijven staan en hoeven NVKFM’ers niet te vrezen voor hun baan.