Inleiding
Het doel van radiotherapie is het vernietigen van de tumorcellen. Tegelijkertijd moeten de gezonde weefsels zo veel mogelijk gespaard worden. De te bestralen doelgebieden in patiënten met hoofd-halskanker zijn vaak groot, complex van vorm en omringd door veel belangrijke organen (zoals het ruggenmerg, het gehoororgaan, de optische structuren, de speekselklieren en de slikstructuren). Bestraling van het hoofd-halsgebied leidt daarom vaak tot acuut en laat optredende bijwerkingen die een negatieve invloed hebben op de kwaliteit van leven van de patiënt. Xerostomie (droge mondklachten) en slikklachten zijn de twee belangrijkste radiotherapie-geïnduceerde laat optredende bijwerkingen die de kwaliteit van leven van patiënten significant negatief beïnvloeden [2,3]. Het is daarom van groot belang om naast het vernietigen van de tumor de functionaliteit van de structuren gerelateerd aan deze bijwerkingen (de speekselklieren en slikstructuren) te behouden.
Bestraling met fotonen
Gedurende de afgelopen decennia zijn de radiotherapietechnieken sterk verbeterd, waardoor het mogelijk is geworden om de hoge stralingsdosis beter te conformeren aan het doelgebied en de omliggende risico-organen zodoende beter te sparen. Meerdere studies hebben aangetoond dat de geavanceerde intensiteitsgemoduleerde bestralingstechniek met fotonen (IMRT, intensity-modulated radiotherapy), in vergelijking met 2D- en 3D-conformatie radiotherapie (fotonen), minder xerostomie en slikklachten geeft en daardoor kan resulteren in een verbeterde kwaliteit van leven [4,5,6,7]. IMRT is de huidige standaardtechniek voor de behandeling van hoofd-halskanker. Echter, IMRT zorgt niet altijd voor een substantiële vermindering van de dosis in de speekselklieren en de slikstructuren. Bestraling met protonen (de bundeleigenschappen van protonen zijn superieur aan die van fotonen), kan daarentegen helpen om de stralingsdosis in de speekselklieren en de slikstructuren verder te verminderen en daarmee de kwaliteit van leven gedurende en na radiotherapie te verbeteren.
In onze studie [8] hebben we de potentiële voordelen onderzocht van gescande intensiteitsgemoduleerde protonentherapie (IMPT, intensity-modulated proton therapy, op dit moment de meest geavanceerde protonentherapietechniek), ten opzichte van de huidige standaard radiotherapietechniek (IMRT), bij hoofd-halskanker in termen van (1) het reduceren van de stralingsdosis in de speekselklieren en de slikstructuren en (2) de geschatte reducties van de kans op xerostomie en slikklachten.
Bestraling met fotonen versus protonen
Fotonen geven hun meeste energie af vlak onder de huid. Hun energieafgifte vermindert daarna geleidelijk naarmate de fotonen dieper het weefsel intreden (Figuur 1). Fotonen hebben een sterk doordringend vermogen, waardoor veel fotonen gericht op de tumor het lichaam weer uittreden zonder enige interactie te zijn aangegaan in het lichaam. Protonen daarentegen hebben een eindige dracht. Na het binnendringen in het weefsel remmen ze af. Hun stralingsdosis neemt eerst heel langzaam toe (zie de plateauregio in Figuur 1). Vervolgens neemt de stralingsdosis sneller toe naarmate de protonen dieper zijn doorgedrongen in het weefsel. Als ze bijna tot stilstand zijn gekomen geven ze hun meeste energie af, ter plaatse van de zogenaamde Bragg piek. Daarna neemt de energieafgifte heel snel af tot nul (Figuur 1). De positie van de Bragg piek hangt af van de protonenenergie en kan gestuurd worden door de gewenste protonenenergie te selecteren. Door de energie van de protonenbundel te variëren vanuit één bundelrichting kan men een zogenaamde spread-out Bragg peak (SOBP) creëren (Figuur 1). Hiermee verleng je in de diepterichting het hoge dosisgebied en is er een zeer lage dosis in het gezonde weefsel direct achter het doelgebied.
Opzet planningsvergelijkende studie
Voor onze zogenaamde planningsvergelijkende studie (fotonentherapie versus protonentherapie) hebben we CT-scans van patiënten gebruikt die eerder in het UMCG zijn behandeld. In het UMCG hebben we de IMRT-bestralingsplannen gesimuleerd (simulatie verwijst naar het feit dat deze patiënten niet daadwerkelijk behandeld zijn met de gegenereerde bestralingsplannen, echter opgemerkt moet worden dat de wijze waarop we de bestralingsplannen hebben gemaakt gelijk is aan de manier waarop we huidig in de klinische praktijk deze IMRT-bestralingsplannen maken). Doordat protonentherapie nog niet beschikbaar is in Nederland hebben we voor het opzetten van de bestralingsplannen met protonen gebruik gemaakt van het planningssysteem (computersysteem waarmee bestralingsplannen opgezet kunnen worden) van het Paul Scherrer Instituut (PSI), een instituut in Zwitserland waar protonentherapie al wel klinisch wordt toegepast. (Daar is de op dit moment meest geavanceerde protonentechniek, IMPT, ontwikkeld).
Voor een en dezelfde patiënt zijn dus zowel een protonenplan als een fotonenplan gemaakt met als doel eenzelfde stralingsdosis in het doelgebied en daarbij de speekselklieren en slikstructuren zo veel mogelijk te sparen (zonder onderdosering toe te staan in het doelgebied). Vervolgens hebben we de stralingsdosisverdelingen in de patiënten geanalyseerd en onderzocht of IMPT, bij eenzelfde stralingsdosis in de tumor, de stralingsdosis in de risico-organen relevant voor xerostomie en slikklachten kan verminderen. Voor de vertaalslag naar de klinische relevantie van deze potentiële stralingsdosisreducties zijn bestaande zogeheten normale weefselschade modellen gebruikt die de kans op de bijwerkingen xerostomie en slikklachten kunnen voorspellen [9, 10, 11].
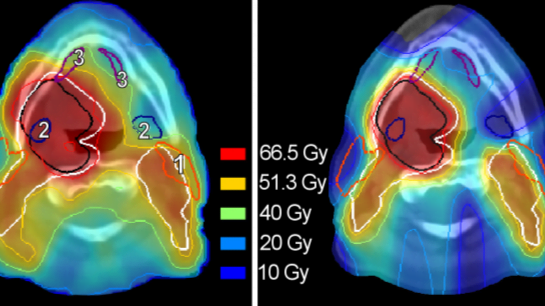
Resultaten
IMPT resulteerde over het algemeen in minder stralingsdosis in de speekselklieren en de slikstructuren (Figuur 2). De gebruikte normale weefselschade modellen voorspelden met protonentherapie een verminderde kans op xerostomie en slikklachten. We verwachten daarom dat protonentherapie zal bijdragen aan een verbeterde kwaliteit van leven tijdens en na de behandeling. Echter, we zagen ook dat voor een deel van de patiënten met IMPT weinig of geen voordeel behaald kon worden.
Maatschappelijke relevantie en conclusie
Protonentherapie is nog niet beschikbaar in Nederland, echter het ministerie van VWS besluit binnenkort over de vergunningen voor protonentherapie. De verwachting is dat er over ongeveer 4 jaar wel een aantal faciliteiten voor protonentherapie zullen zijn. Met deze studie hebben we alvast de potentiële voordelen van protonentherapie bij hoofd-halskanker onderzocht. De studie toonde enerzijds aan dat protonentherapie ten opzichte van fotonentherapie de potentie heeft om het sparen van de speekselklieren en de slikstructuren substantieel te verbeteren. Daarom verwachten we als voordeel minder ernstige bijwerkingen. Anderzijds bleek uit ons onderzoek dat niet alle patiënten substantieel voordeel zullen hebben van protonentherapie. Omdat er op dit moment geen klinische data beschikbaar is over welke hoofd-halskankerpatiënten wel en niet baat zullen hebben bij protonentherapie zou per patiënt, via een planningsvergelijkende studie, onderzocht moeten worden of protonentherapie voordeel biedt ten opzichte van fotonentherapie. Zo kan men patiënten selecteren die hoogstwaarschijnlijk baat zullen hebben bij protonentherapie.
[1] Integraal kankercentrum Nederland
[2] P Dirix et al, Evidence-based organ-sparing radiotherapy in head and neck cancer, Lancet Oncol 2010, pp 85-91
[3] JA Langendijk et al, Impact of late treatmentrelated toxicity on quality of life among patients with head and neck cancer treated with radiotherapy. J Clin Oncol 2008, pp. 3770-3776
[4] A Eisbruch et al, Salivary gland sparing and improved target irradiation by conformal and intensity modulated irradiation of head and neck cancer. World J Surg 2003, pp. 832-837
[5] MK Kam et al, Prospective randomized study of intensitymodulated radiotherapy on salivary gland function in early-stage nasopharyngeal carcinoma patients. J Clin Oncol 2007, pp. 4873-4879
[6] EH Pow et al, Xerostomia and quality of life after intensity-modulated radiotherapy vs. conventional radiotherapy for early-stage nasopharyngeal carcinoma, Int J Radiat Oncol Biol Phys 2006, pp. 981-991
[7] MR Vergeer et al, Intensity-modulated radiotherapy reduces radiation-induced morbidity and improves health-related quality of life, Int J Radiat Oncol Biol Phys 2009, pp. 1-8
[8] TA van de Water, Potential Potential benefits of intensity-modulated proton therapy in head and neck cancer, proefschrift, 2013, Rijksuniversiteit Groningen
[9] VA Semenenko et al, Lyman-Kutcher-Burman NTCP model parameters for radiation pneumonitis and xerostomia based on combined analysis of published clinical data. Phys Med Biol 2008, pp. 737-755
[10] AP Jellema et al, Does radiation dose to the salivary glands and oral cavity predict patient-rated xerostomia and sticky saliva in head and neck cancer patients treated with curative radiotherapy? Radiother Oncol 2005, pp. 164-171
[11] ME Christianen et al, Predictive modelling for swallowing dysfunction after primary (chemo)radiation, Radiother Oncol 2012, pp. 107-114